Contoh Soal Hukum Dasar Kimia & Pembahasan
PEMBAHASAN :
Fe(s) + S(s) → FeS(s)
15 gr 2 gr
Perbandingan massa Fe : massa S = 7 : 4
Massa Fe 15 gr dan massa S 2 gr tidak sesuai dengan perbandingan 7 : 4
Massa Fe akan berlebih, massa Fe yang bereaksi bisa dicari sebagai berikut:
![]()
berdasarkan hukum kekekalan massa:
massa sebelum reaksi = massa sesudah reaksi
massa Fe + Massa S = massa FeS
massa FeS = (3,5 + 2 gr) = 5,5 gram
PEMBAHASAN :
Jika dimisalkan 100% = 100 gram
Terdapat 4 senyawa
Senyawa I mengandung 53,65 gram Cl dan 46,35 gram unsur lain
Senyawa II mengandung 49,10 gram Cl dan 50,9 gram unsur lain
Senyawa III mengandung 43,56 gram Cl dan 56,44 gram unsur lain
Senyawa II mengandung 27,84 gram Cl dan 72,16 gram unsur lain
Kita ubah massa unsur lain menjadi sama menjadi 50 gram
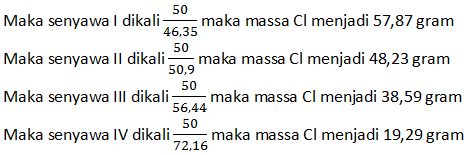
Maka perbandingan Cl di keempat senyawa:
Cl(I) : Cl(II) : Cl(III) : Cl(IV)
57,87 : 48,23 : 38,59 : 19,29
3 : 2,5 : 2 : 1
6 : 5 : 4 : 2 Perbandingan ini bulat dan sederhana sehingga hukum dalton berlaku
PEMBAHASAN :
Jika dimisalkan 100% = 100 gram
Terdapat 3 senyawa
Senyawa I mengandung 20 gram P dan 80 gram R
Senyawa II mengandung 25 gram P dan 75 gram R
Senyawa III mengandung 40 gram P dan 60 gram R
Kita ubah massa unsur R menjadi sama menjadi 75 gram
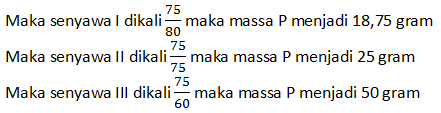
Maka perbandingan P di ketiga senyawa:
P(I) : P(II) : P(III)
18,75 : 25 : 50
3 : 4 : 8
Maka hukum perbandingan berganda berlaku
PEMBAHASAN :
Jika dimisalkan 100% = 100 gram
Terdapat 3 senyawa
Senyawa I mengandung 15 gram A dan 85 gram B
Senyawa II mengandung 30 gram A dan 70 gram B
Senyawa III mengandung 45 gram A dan 55 gram B
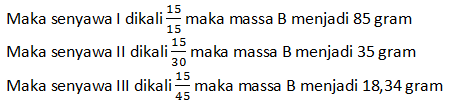
Maka perbandingan B di ketiga senyawa:
B(I) : B(II) : B(III)
85 : 35 : 18,34
255 : 175 : 55
51 : 35 : 11
PEMBAHASAN :
N2(g) + O2(g) → NxOy(g)
2 L 3L 1L
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien, sehingga perbandingan koefisiennya
2 : 3 : 1, masukan koefisiennya ke reaksi
2 N2(g) + 3O2(g) → 1NxOy(g), lalu setarakan
Jumlah atom N
4 = x
Jumlah atom O
6 = y
Sehingga rumus molekulnya
N2O3 (sesudah disederhanakan dan disesuaikan dengan senyawa yang stabil)
Bila volume diukur pada suhu dan tekanan yang sama, berapa volume maksimum uap air yang dapat dihasilkan?
PEMBAHASAN :
Setarakan persamaan reaksinya
2H2(g) + O2(g) → 2H2O(g)
10 L 10 L
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien
Perbandingan koefisiennya = 2 : 1 : 2 = perbandingan volume
Maka dari perbandingan volume, volume H2O akan sama dengan volume H2 = 10 L
PEMBAHASAN :
Reaksi yang terjadi : C4H10(g) + O2(g) → CO2(g) + H2O(g)
Setarakan reaksi
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(g)
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien
Untuk mencari volume gas oksigen diperoleh melalui perbandingan koefisien dengan gas butana
PEMBAHASAN :
Misalkan volume CH4 = x L, maka volume C3H8 = (10 – x)L
Reaksi pembakaran berlangsung masing-masing
CH4 + 2O2 → CO2 + 2H2O (menentukan volume CO2 melalui perbandingan koefisien)
x L x L
C3H8 + 5O2 → 3CO2 + 4H2O
(10-x)L 3(10-x)L
Maka volume total CO2 = x + 30 – 3x = 24 L
24 L = 30 – 2x
2x = 6
x = 3L (Volume CH4)
Sedangkan volume C3H8 = 10 – 3 L = 7 L
Dengan menganggap bahwa kadar oksigen di udara 20%, tentukan volume udara yang diperlukan untuk membakar 4 liter gas amonia.
PEMBAHASAN :
Setarakan reaksi
4NH3(g) + 7O2(g) → 4NO2(g) + 6H2O(g)
Menurut hukum Gay-Lussac : perbandingan volume = perbandingan koefisien
Untuk mencari volume gas oksigen diperoleh melalui perbandingan koefisien dengan gas amonia
PEMBAHASAN :
Misalkan volume CH4 = x mL, maka volume C3H8 = (160 – x)mL
Reaksi pembakaran berlangsung masing-masing
CH4 + 2O2 → CO2 + 2H2O (menentukan volume O2 melalui perbandingan koefisien)
x mL 2x mL
C3H8 + 5O2 → 3CO2 + 4H2O
(160-x)mL 5(160-x)L
Maka volume total O2 = 2x + 800 – 5x = 500 mL
500 mL = 800 – 3x
3x = 300
x = 100 mL (Volume CH4)
Sedangkan volume C3H8 = 160 – 100 mL = 60 mL
Sumber Soal : Kelas X Penerbit Erlangga Pengarang Unggul Sudarmo
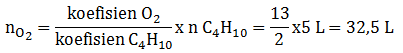


Kak, mau tanya itu yang nomer 18, kok bisa volume total x+30-3x=24 itu caranya bagaimana ya kak? Terimakasih.
Lewat perbandingan koefisien. Volumenya dibandingkan terhadap CO2