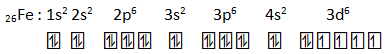Halo anak SMA baru. Selamat yah sekarang kamu ada di kelas X. Materi kimia setelah pengenalan ilmu kimia adalah struktur atom dan sistem periodik unsur (SPU). Daripada baca sebuku tebel, kita kasih kamu ringkasan materinya disini. Selain itu, biar tambah mateng kita kasih gratis video pembelajarannya dan ada 47 contoh soal yang bikin kamu molotok di bab ini. Terakhir coba latihannya juga! Ayo mulai rayapi di daftar isinya yah..
DAFTAR ISI
Rangkuman Materi Struktur Atom & Sistem Periodik Unsur (SPU) Kelas 10
Pengertian Atom
Atom Merupakan partikel terkecil yang sudah tidak dapat dibagi-bagi lagi dengan cara biasa
Partikel Penyusun Atom
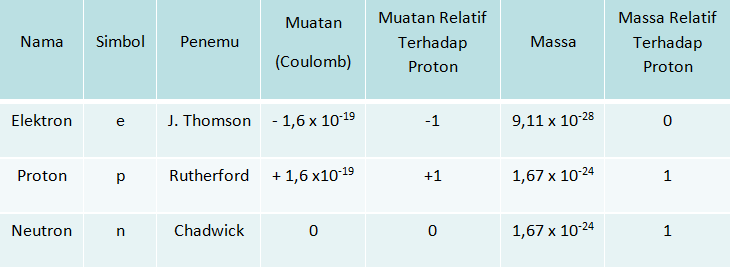
Partikel penyusun inti atom adalah proton dan neutron sedangkan elektron mengelilingi inti atom.
Nomor Atom dan Massa Atom
Nomor atom (Z) menunjukkan jumlah proton dalam atom.
- Untuk atom netral(tidak bermuatan) jumlah proton (p) = jumlah elektron (e)
- Untuk ion negatif (anion) jumlah proton (p) < jumlah elektron (e)
- Untuk ion positif (kation) jumlah proton (p) > jumlah elektron (e),
Massa atom (A) menunjukkan jumlah dari proton (p) dan neutron (n).
A = p + n
Notasi Atom
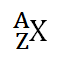
X = Unsur/atom
A = Massa Atom/Nomor Massa = p + n
n = A – p
Z = Nomor Atom = p = e (atom netral)
Contoh Soal
Tentukan nilai A, Z, p, e, n untuk atom berikut :
Jawaban:
- A =23, Z = 11, p = 11, e = 11, n =23-11 = 12
- A =19, Z = 9, p = 9, e = 9, n = 19 – 9 = 10
Notasi Ion
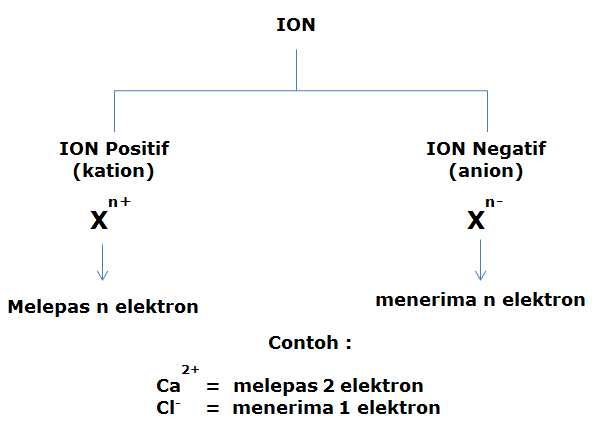
Contoh Soal:
Tentukan nilai A, Z, p, e, n untuk ion berikut :
Jawaban:
- A =23, Z = 11, p =11, e = 11-1 = 10, n = 23 – 11 = 12 (melepas 1 elektron)
- A =16, Z = 8, p =8, e = 8+2 = 10, n = 16 – 8 = 8 (menerima 2 elekron)
Perkembangan Model Atom
Model Atom Dalton
Atom merupakan partikel terkecil suatu materi yang berbentuk bola pejal.
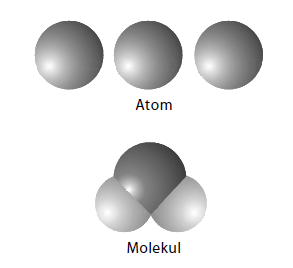
- Atom suatu unsur memiliki sifat yang sama, berbeda dengan unsur yang lain
- Atom dapat bergabung dengan atom lain membentuk suatu molekul dengan perbandingan sederhana.
Model Atom Thomson
Atom merupakan bola yang bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif.
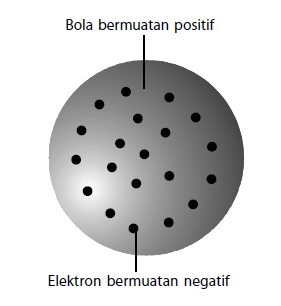
- Model ini timbul karena ditemukannya elektron dalam atom.
- Model ini disebut juga teori Roti Kismis, karena mirip dengan roti kismis.
Model Atom Rutherford
Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron.
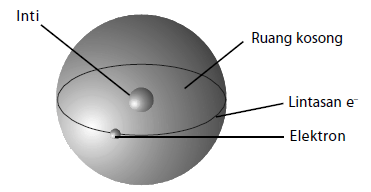
- Model ini lahir karena Rutherford menemukan adanya inti atom melalui percobaannya.
- Kelemahannya yaitu ketidakmampuan menjelaskan mengapa elektron tidak jatuh ke inti akibat gaya tarik elektrostatik
Model Atom Niels Bohr
Atom terdiri atas inti yang terdiri atas proton dan neutron dan dikelilingi oleh elektron pada lintasan dengan tingkat energi yang tetap.
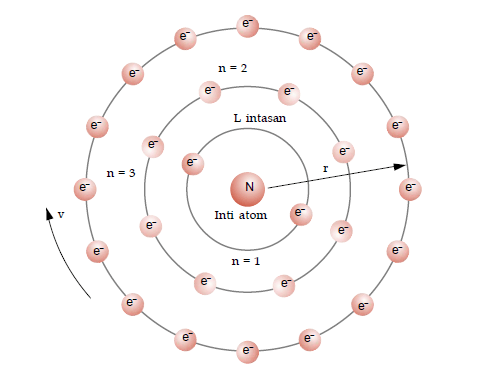
- Elektron dapat berpindah ke tingkat energi yang lebih tinggi (kulit yang lebih besar) dengan menyerap energi.
- Elektron dapat berpindah ke tingkat energi yang lebih rendah (kulit yang lebih kecil) dengan melepas energi.
Kelemahan Teori Atom Bohr
Teori Atom Bohr memiliki beberapa kelemahan, diantaranya:
- Hanya menjelaskan Spektrum atom Hidrogen
- Tidak dapat menjelaskan spektrum atom Hidrogen memiliki garis-garis tambahan (Efek Zeeman dan Efek Strack).
Teori Dasar Munculnya Teori Atom Modern
Dualisme de Broglie:
“Elektron dapat bertindak sebagai partikel juga sebagai gelombang”.
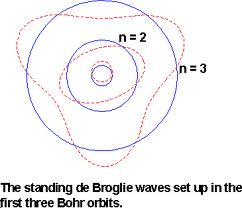
Prinsip Ketidakpastian Heisenberg:
“Elektron tidak ditemukan secara pasti di dalam lintasan tetapi hanya kebolehjadian”.
Daerah Kebolehjadian ditemukannya elektron disebut Orbital
Persamaan Schrödinger
“Schrödinger membuat persamaan gelombang yang didasari pernyataan de broglie”.persamaannya:
![]()
Persamaan ini memperkirakan daerah kebolehjadian ditemukannya elektron (Orbital).
Bilangan Kuantum
- Bilangan kuantum merupakan gambaran kedudukan elektron dalam suatu atom dan membedakannya dengan elektron lainnya.
- Bilangan kuantum diperoleh dari penurunan persamaan Schrödinger.
- Bilangan kuantum memiliki 4 jenis, diantaranya bilangan kuantum utama (n), Bilangan kuantum azimut (l ), Bilangan kuantum magnetik (m) dan Bilangan kuantum spin (s)
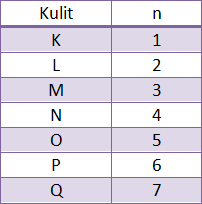
Bilangan kuantum utama (n)
menunjukkan kulit yang ditempati elektron
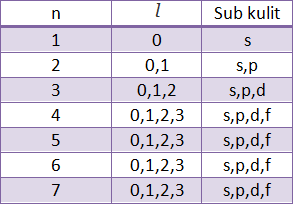
Bilangan kuantum azimut (l )
Menunjukan sub kulit yang ditempati elektron

Hubungan kulit (n) dengan subkulit (l):
lmaks = (n-1)
Bilangan kuantum magnetik (m)
Menunjukan orientasi elektron dalam orbital
Hubungan azimuth (l) dengan magnetik (m):
m = –l, 0, +l
Hubungan ini juga dapat menentukan jumlah orbital masing-masing sub kulit, satu orbital akan diisi maksimal oleh 2 elektron.

Bilangan kuantum spin (s)
Menunjukan arah rotasi elektron
satu orbital diisi oleh maksimal dua elektron, satu mengarah ke atas (s = + ½ ), satu lagi mengarah ke bawah (s= – ½)

Penulisan bilangan kuantum dalam konfigurasi elektron

Contoh soal
- Tentukan harga n dan l elektron yang terletak pada orbital :
- 4s
- 3d
- Tuliskan ke 4 bilangan kuantum yang mungkin pada orbital :
- 4p
- 3d
- 4f
Jawaban
- n = 4 (kulit ke-4), dan l = 0 (subkulit s)
- n = 3 (kulit ke-3), dan l = 2 (subkulit d)
- n = 4, l = 1, m = -1, 0, +1 , s = +½, -½
- n = 3, l = 2, m = -2,-1, 0, +1,+2 , s = +½, -½
- n = 4, l = 3, m = -3,-2,-1, 0, +1,+2,+3 , s = +½, -½
Bentuk Orbital
Orbital s
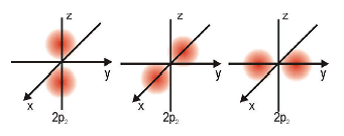
Orbital p
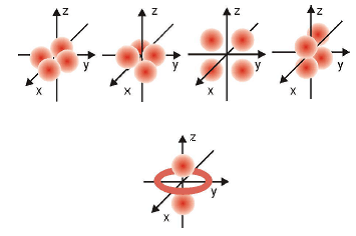
Orbital d
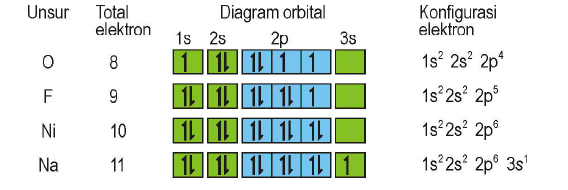
Konfigurasi Elektron
Tiga Aturan konfigurasi atom modern :
Aturan Aufbau (Membangun)
“Pengisian elektron dimulai dari orbital yang tingkat energinya lebih rendah kemudian ke tingkat energi yang lebih tinggi”
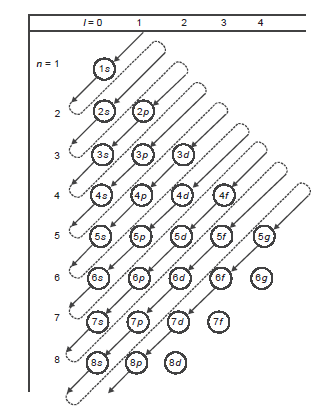
Urutan subkulit dari energi terendah sampai tertinggi yaitu sebagai berikut:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, …dst
Cara cepat menghapal:

Contoh soal konfigurasi elektron:
Tuliskan konfigurasi elektron atom berikut dengan lengkap:
12Mg : 1s2 2s2 2p6 3s2
20Ca : 1s2 2s2 2p6 3s2 3p6 4s2
30Zn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
23V : 1s2 2s2 2p6 3s2 3p6 4s2 3d3
14Si : 1s2 2s2 2p6 3s2 3p2
Aturan Hund
“Pengisian elektron pada orbital yang setingkat energinya mula-mula elektron diisi dengan tidak berpasangan terlebih dahulu sesudah diisikan baru kemudian berpasangan”
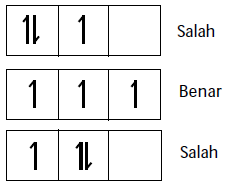
Contoh soal:
Larangan Pauli
Elektron yang menghuni orbital tidak boleh memiliki ke 4 bilangan kuantum yang sama. n, l, m boleh sama tetapi bilangan kuantum s akan berbeda.
Contoh Soal
Tentukan ke 4 bilangan kuantum elektron terakhir dari unsur berikut:
8O : 1s2 2s2 2p4
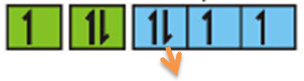
Elektron yang terakhir di tulis
Bilangan kuantumnya:
n = 2, l = 1, m = -1, s = -1/2
Cara Menulis Konfigurasi Singkat
Konfigurasi elektron bisa disingkat menggunakan konfigurasi elektron gas mulia
Konfigurasi gas mulia
2He : 1s2
10Ne : 1s2 2s2 2p6
18Ar : 1s2 2s2 2p6 3s2 3p6
36Kr : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
86Rn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
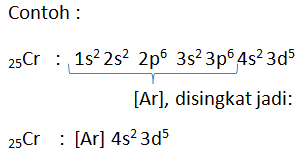
Menentukan dengan lebih cepat:
Caranya:
- Tentukan gas mulia yang dijadikan penyingkat, nomor atom gas mulia harus lebih kecil dari nomor atom yang ditentukan
- Lanjutkan konfigurasi elektron dari gas mulia, caranya:
Sesudah : [He] 2s2
[Ne] 3s2
[Ar] 4s2
[Kr] 5s2
[Xe] 6s2
[Rn] 7s2
Contoh:
Tentukan konfigurasi elektron dengan singkat
- 22Ti
- 17 Cl
- 53 I
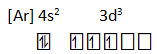
- 22Ti, nomor atomnya 22 dibawahnya ada [18Ar], tersisa tinggal 4 elektron lagi sehingga menjadi
22Ti : [Ar] 4s2 3d2 - 17Cl, nomor atomnya 17 dibawahnya ada [10Ne], tersisa tinggal 7 elektron lagi sehingga menjadi
17Cl : [Ne] 3s2 3p5 - 53I, nomor atomnya 53 dibawahnya ada [36Kr], tersisa tinggal 17 elektron lagi sehingga menjadi
53I : [Kr] 5s2 4d10 5p5
Kestabilan subkulit d terisi penuh dan setengah penuh
Sesuai aturan Aufbau Konfigurasi Cr (24) dan Cu (29) adalah :
24Cr : [Ar] 4s2 3d4
29Cr : [Ar] 4s2 3d9
Kenyataannya ini kurang stabil, yang betul adalah:
24Cr : [Ar] 4s1 3d5
29Cr : [Ar] 4s1 3d10
Hal ini disebabkan karena kondisi 3d4 kurang stabil dibandingkan 3d5, begitu pula 3d9 kurang stabil dibanding 3d10
Menentukan Golongan dan Periode
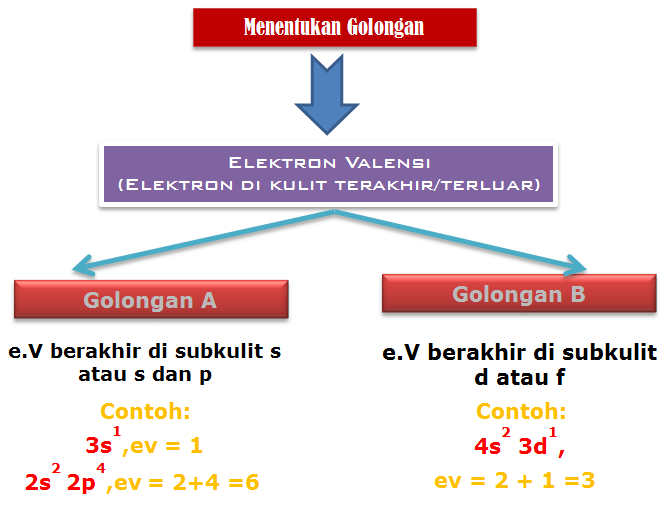
Penentuan Golongan A (Utama)
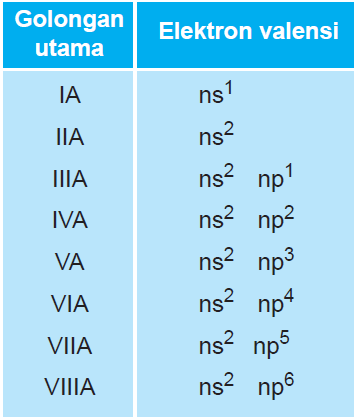
Jumlah elektron valensi merupakan golongan unsur tersebut
Contoh :
- 11Na : 1s2 2s2 2p6 3s1,ev= 1 Golongan = IA
- 8O : 1s2 2s2 2p4,ev = 2+4 =6 Golongan = VI A
Penentuan Periode
Periode ditentukan dari kulit terluar
Contoh:
- 11Na : 1s2 2s2 2p6 3s1, kulit terluar =3 Periode = 3
- 8O : 1s2 2s2 2p4, kulit terluar =2 Periode = 2
Penentuan Golongan B (Transisi)
Jumlah elektron di sub kulit s terakhir dan d merupakan golongan unsur tersebut

Contoh:
- 21Sc : [Ar] 4s2 3d1,ev= 2 + 1 = 3 Golongan = III B
- 30Zn : [Ar] 4s2 3d10,ev= 2 + 10 = 12 Golongan = I B
Penentuan Periode
- 21Fe : [Ar] 4s2 3d1,kulit terakhir = 4 Periode = 4
- 48Cd : [K4] 5s2 4d10,kulit terakhir = 5 Periode = 5
Contoh Soal Struktur Atom & Sistem Periodik Unsur (SPU) Kelas 10
Soal No.11
Tentukan konfigurasi elektron dari ion V3+ jika nomor atom V = 23 Buatlah diagram orbital untuk V3+ tersebut.
PEMBAHASAN :
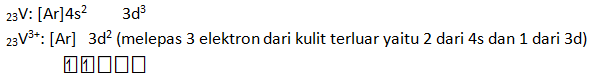
Soal No.12
Diketahui atom besi mempunyai nomor atom 26.
- Tuliskan konfigurasi elektron atom besi
- Ada berapa orbital yang terisi elektron?
- Ada berapa orbital yang terisi elektron tidak berpasangan?
- Bagaimana konfigurasi elektron dari ion Fe3+?
PEMBAHASAN :

- Orbital terisi elektron : 15
- elektron yang tidak berpasangan : 4
- 26Fe3+ : 1s2 2s2 2p6 3s2 3p6 3d5 (melepas 3 elektron dari kulit terluar yaitu 2 dari 4s dan 1 dari 3d)
Soal No.13
Atom A dan B mempunyai konfigurasi elektron sebagai berikut:
A: 1s2 2s2 2p6 3s2 3p5
B: 1s2 2s2 2p6 3s2 3p6
Manakah di antara kedua atom tersebut yang lebih stabil? Jelaskan.
PEMBAHASAN :

Soal No.14
Suatu atom mempunyai konfigurasi elektron : 1s2 2s2 2p64s1. Mungkinkah konfigurasi elektron tersebut dapat terjadi? Berikan alasan Anda.
PEMBAHASAN :
Tidak mungkin terjadi karena menurut aturan aufbau pengisian elektron dimulai dari orbital dengan tingkat energi terendah ke orbital tertinggi. Sesudah 2p seharusnya dilanjutkan ke 3s bukan ke 4s
Soal No.15
Mengapa jumlah subkulit yang menyusun kulit M hanya terdiri dari 3 subkulit? Jelaskan.
PEMBAHASAN :
Hubungan sub kulit dengan kulit yaitu:
lmaks = (n-1)
jika n =3 berarti lmaks = 3-1 = 2
maka sub kulitnya : 0, 1, 2 atau hanya ada 3 sub kulit
Soal No.16
Dengan tanpa melihat sistem periodik unsur, tentukan letak unsur-unsur berikut,
- 26A
- 37B
- 53C
- 48D
PEMBAHASAN :
- 26Fe : 1s2 2s2 2p6 3s2 3p6 4s2 3d6,
e.v = 8 berakhir di sub kulit d maka Gol VIIIB
Jumlah kulit 4 periode 4 - 37B : [Kr] 5s1,
e.v = 1 berakhir di sub kulit s maka Gol IA
Jumlah kulit 5 periode 5 - 53C : [Kr] 5s2 4d10 5p5
e.v = 7 berakhir di sub kulit p maka Gol VII A
Jumlah kulit 5 periode 5 - 48D : [Kr] 5s2 4d10
e.v = 12 berakhir di sub kulit d maka Gol IIB
Jumlah kulit 5 periode 5
Soal No.17
Suatu unsur di dalam sistem periodik terdapat pada golongan VIA periode keempat, tentukanlah konfigurasi elektron unsur tersebut.
PEMBAHASAN :
Golongan VI A berarti elektron valensinya = 6 berakhir di sub kulit p, periode keempat berarti jumlah kulitnya = 4, maka konfigurasi elektronnya: [Ar] 4s2 3d10 4p4
Soal No.18
Apa yang dimaksud dengan unsur-unsur blok d?
PEMBAHASAN :
Unsur yang pengisian elektronnya berakhir di sub kulit d
Soal No.19
Diketahui unsur-unsur dengan konfigurasi elektronnya sebagai berikut:
A : 1s2 2s2 2p6
B: [Ne] 3s2
C: [Ne]3s23p5
D: [Ar] 4s23d104p1
E: [Ar] 4s1
Di antara unsur-unsur tersebut, tentukanlah:
- Unsur-unsur yang terletak dalam satu periode
- Unsur-unsur yang terletak dalam satu golongan
- Unsur yang mempunyai jari-jari atom terbesar
- Unsur yang mempunyai afinitas elektron terbesar
- Urutkanlah harga energi ionisasi unsur-unsur tersebut dari yang paling kecil ke yang paling besar.
PEMBAHASAN :
- Unsur yang satu periode = jumlah kulit sama = unsur B & C kemudian unsur D & E
- Unsur yang satu gelombang = elektron valensi sama = tidak ada unsur yang satu golongan
- Unsur E karena terletak paling kiri dan terbawah
- Unsur C karena yang paling mudah menangkap elektron
- E – B – D – C – A karena dari kiri ke kanan energi ionisasi makin besar dari atas ke bawah makin kecil
Soal No.20
Suatu unsur di dalam sistem periodik terletak pada golongan VB periode keempat.
- Buatlah konfigurasi elektronnya
- Berapa elektron yang tidak berpasangan?
- Bila unsur tersebut membentuk ion yang bermuatan +3, bagaimanakah konfigurasi elektron ionnya?
PEMBAHASAN :
- Golongan VB berarti elektron valensinya = 5 berakhir di subkulit d, periode keempat berarti jumlah kulit = 4, sehingga konfigurasinya:

- Elektron yang tidak berpasangan = 3
- X3+ : [Ar] 3d2 (melepas 3 e dari kulit terluar terlebih dahulu, 2 dari 4s dan 1 dari 3d)