DAFTAR ISI
Rangkuman Materi Reaksi Reduksi & Oksidasi Kelas X (Redoks) & Penyetaraan Reaksi Redoks Kelas XII
Pengertian Reaksi Reduksi dan Oksidasi (Redoks)
- Reaksi reduksi : – Reaksi pelepasan oksigen / Reaksi penangkapan elektron / Penurunan biloks
- Reaksi oksidasi : – Reaksi penangkapan oksigen / Reaksi pelepasan elektron / Kenaikan biloks
Bilangan Oksidasi (Biloks)
- Merupakan bilangan yang menyatakan muatan suatu atom dalam suatu molekul atau ion.
- Aturan biloks:a. biloks unsur bebas = 0, contoh unsur bebas : H2, O2, Na, Fe, P4b. jumlah biloks atom dalam senyawa netral = 0c. jumlah biloks atom dalam ion = muatan ion
- Prioritas biloks :
IA : Li, Na, K, Rb, Cs, B.O = +1
IIA : Be, Mg, Ca, Sr, Ba, B.O = +2 Yang atas didahulukan
Al, B.O = +3 dimasukan nilai B.O nya
F, B.O = −1
H, B. O = +1
O, B.O = -2
S, B.O = -2
VII A : Cl, Br, I, B.O = -1
Penyetaraan Reaksi Redoks
Cara I Metode Bilangan Oksidasi (Biloks):
- Tentukan biloks masing-masing unsur
- Samakan jumlah unsur yang berubah biloks dengan menambahkan koefisien.
- Samakan jumlah selisih biloks dengan kali silang
- Jika reaksi berupa ion:
- Samakan muatan, dengan menambahkan H+ (suasana asam) atau OH– (suasana basa)
- Jika reaksi berupa molekul:
Samakan unsur-unsur dengan urutan: Kation- Anion – Hidrogen – Oksigen
- Samakan jumlah H, dengan menambahkan H2O
Cara II Metode Setengah Reaksi
- Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi
- Samakan jumlah unsur yang berubah biloks.
- Samakan jumlah atom O dengan menambahkan H2O di yang kurang O sebanyak kekurangannya (Suasana asam), atau menambahkan H2O di yang lebih O sebanyak kelebihannya (suasana basa).
- Samakan jumlah atom H dengan menambahkan H+ (suasana asam) atau OH– (suasana basa).
- Samakan muatan dengan menambahkan elektron.
- Samakan jumlah elektron dengan kali silang.
- Tambahkan reaksi.
Contoh Soal Penyetaraan Reaksi Redoks Pembahasan & Jawabannya Kelas 12
Soal No.1
Setarakan Reaksi berikut dengan metode biloks
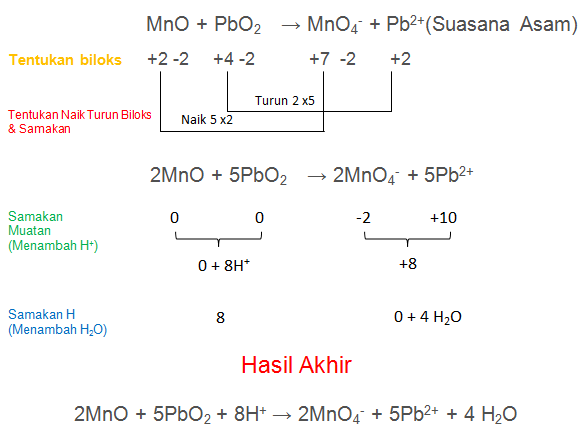
MnO + PbO2 → MnO4− + Pb2+(Suasana Asam)
MnO + PbO2 → MnO4− + Pb2+(Suasana Asam)
PEMBAHASAN :
No.2
Setarakan Reaksi berikut dengan metode biloks
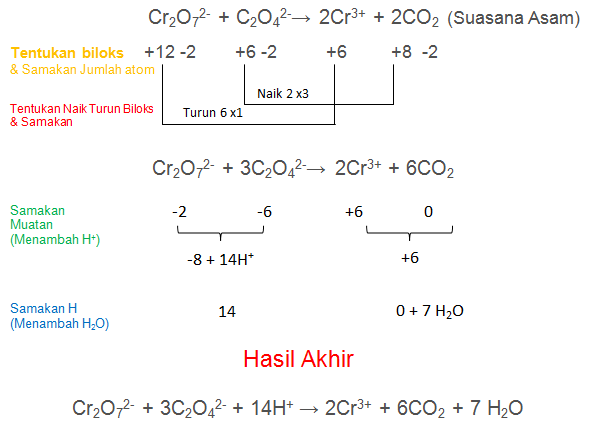
Cr2O72- + C2O42-→ Cr3+ + CO2(Suasana Asam)
Cr2O72- + C2O42-→ Cr3+ + CO2(Suasana Asam)
PEMBAHASAN :
Soal No.3
Setarakan Reaksi berikut dengan metode biloks
Zn + NO3–→ Zn2+ + NH4+(Suasana Asam)
Zn + NO3–→ Zn2+ + NH4+(Suasana Asam)
PEMBAHASAN :

Soal No.4
Setarakan Reaksi berikut dengan metode biloks
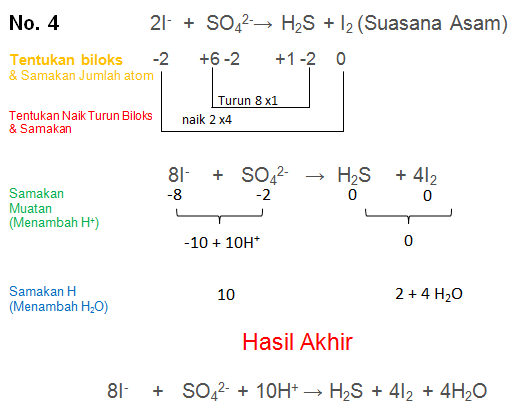
I− + SO42-→ H2S + I2 (Suasana Asam)
I− + SO42-→ H2S + I2 (Suasana Asam)
Soal No.5
Setarakan Reaksi berikut dengan metode biloks
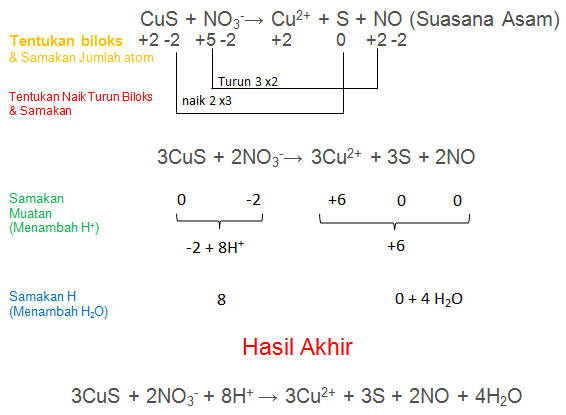
CuS + NO3−→ Cu2+ + S + NO (Suasana Asam)
CuS + NO3−→ Cu2+ + S + NO (Suasana Asam)
PEMBAHASAN :