DAFTAR ISI
Rangkuman Materi Termokimia Kelas 11
Sistem dan Lingkungan
Lingkungan : Bagian di luar sistem.
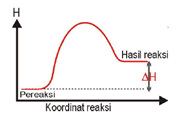
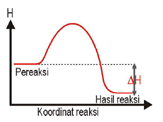
Perbedaan Reaksi Endoterm & Eksoterm
Reaksi Endoterm | Reaksi Eksoterm |
Terjadi perpindahan kalor dari lingkungan ke sistem (sistem menyerap kalor dari lingkungan). | Terjadi perpindahan kalor dari sistem ke lingkungan (sistem melepas kalor ke lingkungan). |
| ΔH = + atau ΔH > 0 | ΔH = – atau ΔH < 0 |
 |  |
Perubahan Entalpi Standar (ΔH0)
Perubahan entalpi pembentukan standar (ΔH0f)
Perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil.
Unsur-unsur stabil :
| Monoatomik | Diatomik | Poliatomik |
| Gol I A, Gol, IIA, Gol Transisi, C, Pb, S | F2, Cl2, Br2, I2, H2, O2, N2 | P4, S8 |
Contoh pembentukan air:
H2 (g) + ½O2 (g) → H2O (l) ΔH = -285,5 kJ
Perubahan entalpi penguraian standar (ΔH0d)
Perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil. Contoh Penguraian C2H6 :
C2H6 (g) → 2C (s) + 3 H2 (g) ΔH = -x kJ
Perubahan entalpi pembakaran standar (ΔH0c)
Perubahan entalpi yang terjadi pada pembakaran 1 mol suatu senyawa menjadi CO2 (pembakaran sempurna)/CO(pembakaran tidak sempurna) dan H2O. Contoh Pembakaran CH4
CH4(g) + 4O2 (g)→ CO2 (g) + 2H2O (l) ΔH = +x kJ
Persamaan Termokimia
Persamaan reaksi yang menunjukkan informasi DH . Didalam persamaan termokimia :
Koefisien = Mol
Contoh :
H2 (g) + ½ O2 (g) → H2O (l) ΔH = -285,5 kJ
Dibaca :
1 mol gas hidrogen bereaksi dengan ½ mol gas oksigen menghasilkan air dengan melepaskan kalor sebesar 285,5 kJ
Perhitungan Persamaan Termokimia Berlaku :
- Jika reaksi dibalik, nilai ΔH berubah tanda dari + ke – dan sebaliknya.
- Jika reaksi dikali x, maka nilai ΔH dikali x.
- Jika reaksi dibagi x, maka nilai ΔH dibagi x.
Perhitungan ΔH
Cara 1 : Percobaan
qreaksi = – (qsistem + qkalorimeter)
qsistem = m . c . ΔT
qkalorimeter = C . ΔT
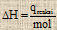
m = massa zat (gram)
c = kalor jenis (J/g 0C)
C = kapasitas jenis (J/0C)
ΔT = Perubahan suhu
Cara 2 : Hukum Hess
Kalor reaksi pada suatu reaksi tidak bergantung pada jalannya reaksi, tetapi hanya bergantung pada keadaan awal dan akhir reaksi
Atau
Perubahan entalpi suatu reaksi tetap sama, baik
berlangsung dalam satu tahap maupun beberapa tahap
Cara 3 : Penentuan ΔHreaksi dari data ΔH0f
ΔHreaksi = (ΣΔH0f produk – ΣΔH0f pereaksi)
Contoh :
pA + qB ® rC + sD DHr = ……?
ΔHreaksi = (ΔH0f C x r + ΔH0f D x s)–(ΔH0f A x p + ΔH0f B x q)
Cara 4 : Penentuan ΔHreaksi dari data Energi Ikatan
ΔHreaksi = (Energi total pemutusan ikatan – Energi total pembentukan ikatan)
Contoh Soal Termokimia Pembahasan & Jawaban Kelas 11
Soal No.1
Jelaskan pengertian sistem dan lingkungan
PEMBAHASAN :
Sistem adalah segala sesuatu yang menjadi pusat perhatian, sedangkan Lingkungan yaitu hal-hal di luar sistem yang membatasi sistem dan dapat mempengaruhi sistem
Soal No.2
Di dalam gelas kimia direaksikan amonium klorida padat dengan barium hidroksida padat sehingga dihasilkan barium klorida, air, dan gas amonia. Pada reaksi tersebut ternyatasuhu sistem turun dari 25oC menjadi 12oC
Dari fakta tersebut:
- Tunjukkan manakah yang menjadi sistem dan lingkungannya
- Temukan apakah reaksi termasuk reaksi endoterm atau eksoterm
- Buatlah diagram tingkat energinya
PEMBAHASAN :
- Sistem : Amonium klorida, barium hidroksida, barium klorida, air dan gas amonia, Lingkungan : Gelas kimia
- Karena terjadi penurunan suhu sistem maka reaksi termasuk reaksi endoterm.
- diagram tingkat energi
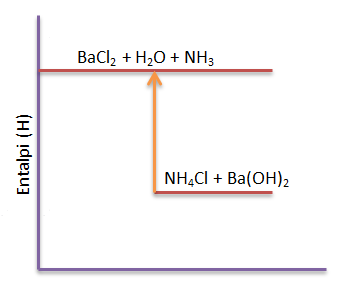
Soal No.3
Jika arang (karbon) dibakar dengan oksigen menjadi gas karbondioksida, akan dilepaskan kalor sebesar 393,5 kJ/mol. Tuliskan persamaan termokimianya dan diagram energinya
PEMBAHASAN :
Persamaan Termokimia:
C(s) + O2(g) → CO2(g) ∆H = -393,5 kJ/mol
Diagram energi
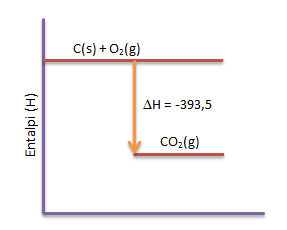
Soal No.4
Tuliskan persamaan termokimia dari pernyataan berikut
a. ∆Hfo CaCO3(s) = -1.207 kJ/mol
b. ∆Hco CH3OH(l) = -638 kJ/mol
PEMBAHASAN :
a. Ca(s) + C(s) + 3/2 O2(g) → CaCO3(s) ∆H = -1.207 kJ/mol
b. CH3OH(l) + O2 (g) → CO2(g) + H2O(l) ∆H = -638 kJ/mol
Soal No.5
Pada pembakaran 1,6 gram gas metana (CH4) dibebaskan kalor 80,2 kJ. Tentukan ∆Hco CH4 dan tuliskan persamaan termokimianya (Ar C = 12, H = 1)
PEMBAHASAN :
menentukan jumlah mol CH4
![]()
0,1 mol CH4 melepaskan 80,2 kJ, ditanyakan ∆Hco (1 mol) dihitung melalui perbandingan
![]()
Persamaan termokimianya:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Soal No.6
Pada peruraian gas amonia menjadi gas hidrogen dan gas nitrogen diperlukan kalor 46 kJ tiap mol amonia. Tentukan ∆Hfo gas amonia dan tuliskan persamaan termokimianya
PEMBAHASAN :
Reaksi peruraian amonia:
NH3(g) → ½ N2(g) + 3/2 H2(g) ∆H = +46 kJ/mol
Yang ditanyakan adalah ∆Hfo yaitu reaksi pembentukan standar yang merupakan kebalikan dari reaksi peruraian, sehingga nilai ∆H nya menjadi kebalikannya atau ∆Hfo = -46 kJ/mol, persamaan termokimianya:
½ N2(g) + 3/2 H2(g) → NH3(g) ∆H = -46 kJ/mol
Soal No.7
Ke dalam kalorimeter sederhana direaksikan 25 mL larutan H2SO4 0,5 M dan 25 mL KOH 1,0 M pada suhu 23,5 oC. Ternyata, temperaturnya naik menjadi 30,17 oC. Hitunglah perubahan entalpi reaksi yang terjadi. (Anggaplah bahwa massa jenis larutan 1 g/mL dan kalor jenis larutan 4,2 J/g K)
PEMBAHASAN :
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
massa larutan = ρlarutan.Vtotal= 1.(25+25) = 50 gram
∆T = (30,17 – 23,5)oC = (303,17 – 296,5) K = 6,67 K
qlar = mlar x c x ∆T
qlar = 50 gram x 4,2 J/g K x 6,67 K = 1400,7 J = 1,4 kJ
mol H2SO4 = 25 mL x 0,5 M = 12,5 mmol
mol KOH = 25 mL x 1 M = 25 mmol
mencari mol H2O
s – – 12,5 25
mol H2O = 25 mmol = 2,5 x 10-2 mol
maka untuk 1 mol H2O
![]()
Soal No.8
Asam benzoat murni (∆Hc C6H5COOH = -3.277 kJ/mol) sebanyak 1,22 gram (saya koreksi) dimasukkan ke dalam kalorimeter bom yang berisi 1.200 g air (kapasitas kalor kalorimeter = 1.365 J/oC; kalor jenis air 4,18 J/g oC). Hitunglah kenaikan suhu kalorimeter yang terjadi. (Ar C = 12, O = 16, H = 1)
PEMBAHASAN :
menentukan mol asam benzoat
![]()
qreaksi = ∆H x mol = -3.277 kJ/mol x 0,01 mol = -32,77 kJ = -32.770 J
qreaksi = -(qlarutan + qkalorimeter)
qreaksi = -(m.c.∆T + C.∆T)
-32.770 J = – (1200.4,18.∆T + 1.365.∆T)
32.770 J = 6381.∆T
∆T = 5,13
Soal No.9
ke dalam suatu kalorimeter direaksikan 50 cm3 larutan CuSO4 0,1 M dengan serbuk seng (massa seng diabaikan). Ternyata, termometer menunjukkan kenaikan suhu 9 oC. Jika kalor jenis larutan dianggap 4,2 J/g K dan massa jenis larutan 1 g/cm3, tentukan ∆H dari reaksi: CuSO4 + Zn → Cu + ZnSO4
PEMBAHASAN :
massa larutan = ρ.V = 1 x 50 cm3 = 50 gram
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
qreaksi = m.c.∆T
qreaksi = 50.4,2.9 = 1890 J = 1,89 kJ
mol CuSO4 = 0.05 L x 0,1 M = 0,005 mol
∆H = qreaksi/mol = 1,89 kJ/0,005 mol = 378 kJ/mol
Soal No.10
Sebanyak 9,6 gram kristal LiOH ditambahkan ke dalam kalorimeter yang berisi 150 gram air. Setelah kristal LiOH larut, suhu kalorimeter beserta isinya naik dari 27 oC menjadi 33,5 oC. Tentukan entalpi pelarutan LiOH dalam air. (Kalor jenis larutan = 4,2 J/goC dan kapasitas kalor kalorimeter = 11,7 J/oC)
PEMBAHASAN :
qreaksi = -(qlarutan + qkalorimeter)
qreaksi = -(m.c.∆T + C.∆T)
qreaksi = -((9,6+150).4,2.(33,5-27) + 11,7.(33,5-27))
qreaksi = -4433,13 J
menentukan mol LiOH
![]()
menentukan ∆H LiOH untuk 1 mol
![]()
Soal No.11
Pembakaran sempurna 4 gram metana membentuk gas karbon dioksida dan air pada keadaan standar menghasilkan 55,625 kJ. Tentukan entalpi pembakaran molar standar metana
PEMBAHASAN :
menghitung jumlah mol metana
![]()
untuk 1 mol (entalpi pembakaran molar standar)
![]()
Soal No.12
2P(s) + O2(g) + 3Cl2(g) → 2POCl3(g) ∆H = -1.150 kJ
H2(g) + Cl2(g) → 2HCl(g) ∆H = -184 kJ
2P(s) + 5Cl2(g) → 2PCl5(g) ∆H = -640 kJ
2H2(g) + O2(g) → 2H2O(g) ∆H = -482 kJ
Hitunglah ∆H untuk reaksi:
PCl5(g) + H2O(g) → POCl3(g) + 2HCl(g)
PEMBAHASAN :
Untuk mencari ∆H melalui hukum Hess dalam bentuk reaksi yaitu cari patokan yaitu zat yang ada muncul satu kali di reaksi-reaksi yang diketahui ∆H nya. Patokan untuk soal ini adalah PCl5, H2O, POCl3, HCl. Kemudian sesuaikan reaksi diketahui sesuai dengan posisi dan jumlah patokan yang ada di reaksi yang ditanyakan, kemudian reaksi dijumlahkan (Jika ada yang sama di kiri dan kanan bisa di coret)sehingga menjadi:
Reaksi I (dibagi 2) : P(s) + ½ O2(g) + 3/2Cl2(g) → POCl3(g) ∆H = -575 kJ
Reaksi II (Tetap) : H2(g) + Cl2(g) → 2HCl(g) ∆H = -184 kJ
Reaksi III (Dibalik & Dibagi 2) : PCl5 → P(s) + 5/2 Cl2(g) ∆H = +320 kJ
Reaksi IV (Dibalik & Dibagi 2) : H2O(g) → H2(g) + ½ O2(g) ∆H = +241 kJ +
PCl5(g) + H2O(g) → POCl3(g) + 2HCl(g) ∆H = -198 kJ
Soal No.13
Diketahui:
∆Hfo H2O(l) = -285,5 kJ/mol
∆Hfo CO2(g) = -393,5 kJ/mol
∆Hfo C3H8(g) = -103 kJ/mol
- Hitunglah ∆Hc C3H8
- Berapa kalor yang dilepaskan jika 10 gram C3H8 dibakar sempurna (Ar C = 12, H = 1)
PEMBAHASAN :
- Jika diketahui data ∆Hfo maka penentuan ∆Hreaksi bisa dicari melalui rumus:
∆Hr = (S∆Hfo produk x koefisien) – (S∆Hfo pereaksi x koefisien)
Reaksi ∆Hc C3H8 yaitu :
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
∆Hr = (∆Hfo CO2 x 3 + ∆Hfo H2O x 4) – (∆Hfo C3H8 x 1 + ∆Hfo O2 x 5)
∆Hr = (-393,5 x 3 + -285,5 x 4) – (-103 + 0)
∆Hr = -2219,5 kJ/mol - menghitung jumlah mol C3H8

maka ∆Hr nya

Soal No.14
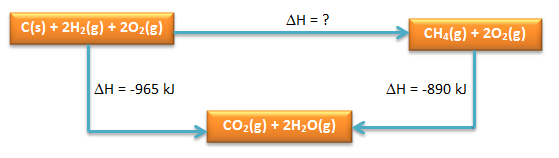
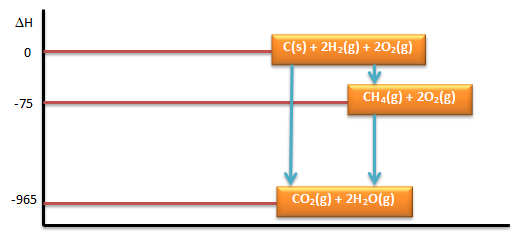
Hitunglah:
a. ∆Hfo CH4(g)
b. Buatlah diagram tingkat energinya
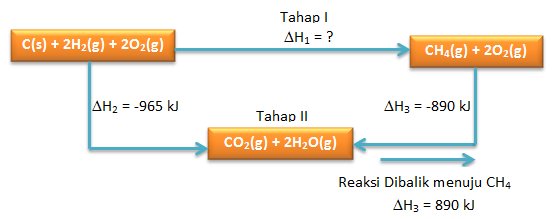
PEMBAHASAN :
- menentukan ∆Hfo CH4(g) kita lihat kembali diagramnya

∆Hfo CH4 dapat ditentukan melalui hukum Hess
Dimisalkan ∆Hfo CH4 yaitu ∆H1 (Tahap I) dan reaksi yang diketahui sebagai ∆H2 dan ∆H3 (Tahap II)
dimana berlaku:
Tahap I = Tahap II
∆H1 = ∆H2 + ∆H3
∆H1 = -965 + 890
∆H1 = ∆Hfo CH4 = -75 kJ/mol - Diagram Tingkat Energinya

Soal No.15
Jika spiritus dianggap hanya mengandung alkohol (C2H5OH) saja, berapa gram spiritus harus dibakar untuk menaikkan suhu 100 gram air dari 20 oC menjadi 50 oC? (Dianggap hanya 50% saja kalor yang terpakai)
Diketahui:
∆Hfo H2O(g) =-240 kJ/mol
∆Hfo CO2(g) =-394 kJ/mol
∆Hfo C2H5OH(g) =-277 kJ/mol
Ar C = 12, H = 1, O = 16
PEMBAHASAN :
menghitung kalor yang diperlukan untuk memanaskan air
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
qreaksi = -(m.c.∆T)
qreaksi = -(100.4,2.30) = -12600 J = -12,6 kJ
menghitung ∆Ho C2H5OH
reaksi pembakaran C2H5OH
C2H5OH + 3O2 → 2CO2 + 3H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 3) – (∆Hfo C2H5OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -240 x 3) – (-277 + 0)
∆Hr = -1231 kJ/mol
kalor yang dilepaskan oleh spiritus adalah 2 x -12,6 kJ = -25,2 kJ karena 12,6 itu hanya 50% dari keseluruhan kalor yang dilepaskan
Jadi jumlah mol spiritus adalah
![]()
![]()
Gr C2H5OH = n x Mr = 0,02 x 46= 0,92 gram
Soal No.16
Diketahui:
∆Hfo CO2(g) =-394 kJ/mol
∆Hfo H2O(g) =-285 kJ/mol
∆Hfo C2H4(g) =+52 kJ/mol
Hitunglah kalor yang dilepas pada pembakaran 6,72 liter gas C2H4 pada suhu 0oC, 1 atm (Ar C = 12, H = 1)
PEMBAHASAN :
menghitung ∆Ho C2H4
reaksi pembakaran C2H4
C2H4 + 3O2 → 2CO2 + 2H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 2) – (∆Hfo C2H4OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -285 x 2) – (+52 + 0)
∆Hr = -1410 kJ/mol
menghitung jumlah mol C2H4 dalam keadaan STP
![]()
maka:
∆H = -1410 kJ/mol x 0,3 mol = -423 kJ
Soal No.17
Diketahui ∆Hfo CaCO3(s) = -1.207 kJ/mol, ∆Hfo CaO(s) = -635,5 kJ/mol, dan ∆Hfo CO2(g) = -394 kJ/mol
Tentukan perubahan entalpi pada proses peruraian CaCO3 dengan reaksi:
CaCO3(s) → CaO(s) + CO2(g)
PEMBAHASAN :
∆Hr = (∆Hfo CO2 x 1 + ∆Hfo CaO x 1) – (∆Hfo CaCO3 x 1)
∆Hr = (-394 x 1 + -635,5 x 1) – (-1.207)
∆Hr = 177,5 kJ/mol
Soal No.18
Diketahui:
HCN(aq) → H+(aq) + CN–(aq) ∆H = +42,8 kJ
H2O (l) → H+(aq) + OH–(aq) ∆H = +53,2 kJ
Hitunglah ∆H dari reaksi : HCN(aq) + OH–(aq) → H2O(l) + CN–(aq)
PEMBAHASAN :
Reaksi 1 (tetap) : HCN(aq) → H+(aq) + CN–(aq) ∆H = +42,8 kJ
Reaksi 2 (dibalik) : H+(aq) + OH–(aq) → H2O (l) ∆H = -53,2 kJ +
Sehingga : HCN(aq) + OH–(aq) → H2O(l) + CN–(aq) ∆H = -10.4 kJ
Soal No.19
Diketahui persamaan termokimia sebagai berikut.
C4H9OH(l) + 6O2(g) → 4CO2(g) + 5H2O(g) ∆H = -2.456 kJ
(C2H5)2O(l) + 6O2 → 4CO2(g) + 5H2O(g) ∆H = -2.510 kJ
Hitunglah perubahan entalpi untuk reaksi:
(C2H5)2O(l) → C4H9OH(l)
PEMBAHASAN :
Reaksi 1 (dibalik) : 4CO2(g) + 5H2O(g) → C4H9OH(l) + 6O2(g) ∆H = +2.456 kJ
Reaksi 2 (tetap) : (C2H5)2O(l) + 6O2 → 4CO2(g) + 5H2O(g) ∆H = -2.510 kJ +
Sehingga : (C2H5)2O(l) → C4H9OH(l) ∆H = -54 kJ
Soal No.20
Perhatikan siklus Hess berikut.
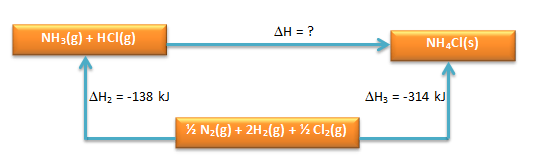
Dari siklus Hess di atas, hitunglah nilai perubahan entalpi reaksi:
NH3 + HCl(g) → NH4Cl(s)
PEMBAHASAN :
perhatikan kembali siklusnya
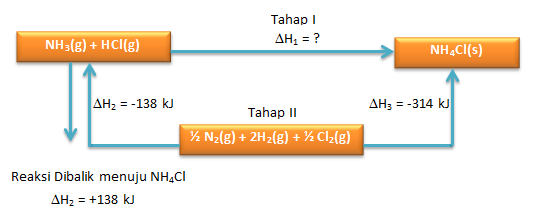
Dimisalkan ∆Hreaksi NH3(g) + HCl(g) → NH4C(s) yaitu ∆H1 (Tahap I) dan reaksi yang diketahui sebagai ∆H2 dan ∆H3 (Tahap II)
dimana berlaku:
Tahap I = Tahap II
∆H1 = ∆H2 + ∆H3
∆H1 = +138 kJ + (-314) kJ
∆H1 = -176 kJ/mol
Soal No.21
Diketahui C2H4(g) → 2C(g) + 4H(g) ∆H = +2.266 kJ dan energi ikatan rata-rata C-H = 413 kJ/mol. Hitunglah energi iakatan rata-rata C=C
PEMBAHASAN :
Struktur ikatannya adalah:
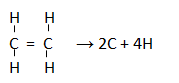
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( C=C + 4xC-H) – (0)
+2.266 = ( C=C + 4×413)
C=C = 2.266 – 1652 = +614 kJ/mol
Soal No.22
Jika Diketahui energi ikatan S-O = 469 kJ/mol, S=O = 323 kJ/mol, dan O=O = 495 kJ/mol, hitunglah perubahan entalpi dari reaksi berikut:
SO2(g) + 1/2 O2(g) → SO3(g)
PEMBAHASAN :
Struktur ikatannya adalah:
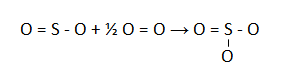
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( S=O + S – O + ½ O=O) – (S=O + 2xS-O)
∆H = ( 323 + 469 + ½ . 495) – (323 + 2×469)
∆H = (1039,5) – (1261) = -221,5 kJ/mol
Soal No.23
Jika diketahui energi ikatan rata-rata H-H = 436 kJ/mol, Br-Br = 192 kJ/mol dan H-Br = 366 kJ/mol, hitunglah ∆Hfo HBr.
PEMBAHASAN :
Reaksi pembentukan HBr adalah:
½ H2(g) + ½ Br2(g) → HBr(l)
Struktur ikatannya:
½ H-H + ½ Br-Br → H-Br
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( ½ H-H + ½ Br-Br) – (H-Br)
∆H = ( ½.436 + ½.192) – (366)
∆H = (314) – (366) = -52 kJ/mol
Soal No.24
Diketahui:
∆Hfo CO2(g) = -394 kJ/mol
∆Hfo H2O(g) = -285 kJ/mol
∆Hco CH4(g) = -802 kJ/mol
Energi ikatan rata-rata H-H = 436 kJ/mol
Energi atomisasi C(s) → C(g) ∆H = +715 kJ
Tentukan energi ikatan C-H pada CH4
PEMBAHASAN :
Reaksi pembentukan H2O
½ H2 + ½ O2 → H2O ∆H = -285 kJ/mol
Struktur ikatannya:
½ H-H + ½ O=O → H-O-H
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( ½ H-H + ½ O=O) – (H-Br)
-285 = ( ½.436 + ½.O=O) – (2xO-H)
2xO-H = 503 + ½ O=O
Reaksi pembentukan CO2
C + O2 → CO2 ∆H = -394 kJ/mol
Struktur ikatannya:
C + O=O → O=C=O
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( C + O=O) – (2xC=O)
-394 = ( 715 + O=O) – (2xC=O)
2xC=O = 1109 + O=O
Reaksi pembakaran CH4
CH4 + 2O2 → CO2 + 2H2O ∆H = -802 kJ/mol
Struktur ikatannya:
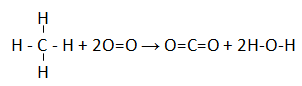
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = (4xC-H + 2xO=O) – (2xC=O + 4xO-H)
– 802 = ( 4xC-H + 2O=O) – ((1109 + O=O)+(2x(503 + ½ O=O))
– 802 = ( 4xC-H + 2O=O) – ((1109 + O=O)+(1006 + O=O))
– 802 = ( 4xC-H + 2O=O) – (2115 + 2O=O)
-802 = (4xC-H -2115)
4xC-H = -802 + 2115
C-H = 328,25 kJ/mol
Soal No.25
Diketahui ∆Hfo CO2(g) = -394 kJ/mol, ∆Hfo H2O(g) = -285 kJ/mol, dan ∆Hfo C2H5OH(l) = -227 kJ/mol. Tentukan nilai kalor bakar dari alkohol (C2H5OH). (Ar C = 12, H = 1, O = 16)
PEMBAHASAN :
Mr C2H5OH
Reaksi pembakaran C2H5OH
C2H5OH + 3 O2 → 2CO2 + 3H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 3) – (∆Hfo C2H5OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -285 x 3) – (-227 + 0)
∆Hr = -1643 + 227 = -1416 kJ/mol
Nilai kalor bakar = ∆Hr x Mr = -1416 kJ/mol x 46 = 65.136 kJ/gram
Sumber Soal : Kimia Kelas XI, Pengarang Unggul Sudarmo Penerbit Erlangga

makasih
Terima kasih, kak. Lengkap sekali, hehe…
Makasih banyak kak pembahasan dan contoh soalnya.
maaf aku mau tanya yang nomer 7, itu perubahan suhunya kan 6,67 derajat celsius, berarti kalau ke kelvin harusnya jadi 279,67 kak? atau saya salah?
nilai delta T akan selalu sama baik dalam celcius maupun dalam kelvin karena merupakan selisih