Lanjut lagi kita akan belajar bab konsep mol & stoikiometri. Bab ini penting kamu pelajari untuk menguasai materi selanjutnya di kimia terutama yang berkaitan dengan perhitungan. Jadi simak yah rangkuman materi dan contoh soal konsep mol & stoikiometri buat kamu kelas 10. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini. Selamat belajar
DAFTAR ISI
Rangkuman Materi Konsep Mol, Stoikiometri Reaksi Kelas 10
Mol merupakan satuan jumlah yang digunakan para ahli kimia untuk menentukan jumlah zat.
Satuan jumlah yang sering digunakan dalam kehidupan sehari-hari misalnya:
1 Lusin = 12 buah
1 mol = 6,02 x 1023 partikel zat
Bila terdapat 1 mol molekul H2O maka terdapat 6,02 x 1023 molekul H2O
Bila terdapat 1 mol atom Fe maka terdapat 6,02 x 1023 atom Fe
Rumusan Mol
Hubungan mol (n) dengan Jumlah Parikel (JP)
Dijelaskan bahwa 1 mol terdapat 6,02 x 1023 atau jika dibuat rumusan:
![]() atau JP = n x L
atau JP = n x L
Keterangan:
n = mol
JP = Jumlah partikel
L = bilangan avogadro (6,02 x 1023)
Contoh Soal:
- Tentukan jumlah mol Fe dari 3,01 x 1022 atom Fe!
- Tentukan Jumlah molekul H2O dari 1,5 mol H2O!
- Tentukan Jumlah atom N dari 2 mol NH3!
- Tentukan Jumlah atom total dari 4 mol H2SO4!
Jawaban:
 ,
,  = 0,5 mol
= 0,5 mol- JP = n x L ; JP = 1,5 mol x 6,02 x 1023 molekul ; JP = 9,03 x 1023
- Untuk menentukan jumlah atom jika diketahui mol molekulnya menggunakan rumus JP = a x n x L
Keterangan:
JP = Jumlah atoma = Jumlah atom yang ditanyakan pada rumus molekul
n = mol
L = Bilangan Avogadro (6,02 x 1023)
Maka jumlah atom N dari 2 mol NH3 adalah:
JP = a x n x L
JP = 1 x 2 mol x 6,02 x 1023
JP = 12,04 x 1024 - Menggunakan rumus yang sama dengan no.3
JP = a x n x L
JP = 7 x 4 mol x 6,02 x1023
JP = 168,56 x 1023 = 1,68 x 1025
Hubungan mol dengan massa/gram
Massa molar (Mm) merupakan massa suatu zat jika jumlahnya 1 mol. Jika jumlahnya bukan 1 mol massa zat dapat dihitung dengan rumus:
![]() atau Gram = n x Mm
atau Gram = n x Mm
Massa molar atom akan sama dengan massa atom relatifnya (Ar)
Massa molar molekul akan sama dengan massa molekul relatifnya (Mr), sehingga rumusnya bisa berubah menjadi:
![]() atau Gram = n x Ar/Mr
atau Gram = n x Ar/Mr
Menentukan Ar bisa dilihat di SPU, nilai Ar sama dengan A (massa atom)
Menentukan Mr bisa dihitung dari penjumlahan Ar unsur penyusunnya dikali jumlah atomnya masing-masing. Contoh:
Mr H2SO4 = Ar H x 2 + Ar S x 1 + Ar O x 4
Mr Na3PO4 = Ar Na x 3 + Ar P x 1 + Ar O x 4
Contoh Soal:
1. Diketahui 46 gram logam Na tentukan jumlah molnya diketahui Ar Na =23!
2. Tentukan massa dari 2 mol CaCO3 jika diketahui (Ar Ca = 40, Ar C =12, Ar O =16)
Jawaban:
 ;
;  ; n = 2 mol
; n = 2 mol- Gram = n x Ar/Mr
Gr = 2 x Mr CaCO3
Mr CaCO3 = Ar Ca x 1 + Ar C x 1 + Ar O x 3 = 40 x 1 + 12 x 1 + 16 x 3 = 40 + 12 + 48 = 100
Gr = 2 x Mr CaCO3
Gr = 2 x 100
Gr = 200 gram
Hubungan mol dengan Volume pada kondisi STP (Standar Temperature and Pressure)
Kondisi STP merupakan kondisi standar dimana pada kondisi tersebut Tekanannya (P) = 1 atm dan suhunya (T) = 00C. Volume (V) pada kondisi STP untuk 1 mol nilainya 22,4 Liter sedangkan selain 1 mol volumenya dapat dihitung dengan rumus:
![]() atau V = n x 22,4 L
atau V = n x 22,4 L
Keterangan : V = volume (Liter)
Tambahan : 1 Liter = 1000 mL
Contoh Soal:
- Berapa jumlah mol 44,8 L gas oksigen yang diukur pada keadaan standar?
- Berapa Liter volume 0,5 mol gas hidrogen jika diukur pada keadaan STP?
Jawaban:
 ;
;  ; n = 2 mol
; n = 2 mol- V = n x 22,4 L ; V = 0,5 mol x 22,4 L ; V = 11,2 L
Hubungan mol dengan Volume pada kondisi Non STP
Kondisi Non STP merupakan kondisi dimana Tekanannya (P) tidak sama dengan 1 atm atau suhunya (T) tidak sama dengan 00C. Volume dan mol dapat dihitung dengan rumus:
![]() atau
atau ![]()
Keterangan:
V = Volume (Liter)
P = Tekanan (atm) jika dikonversi 1 atm = 76 cmHg atau 1 atm = 760 mmHg
n = mol
R = Tetapan gas umum ( 0,082 Latm/kmol)
T = Suhu (Kelvin) jika dikonversi dari celcius maka Kelvin = celcius + 273
Contoh Soal:
Berapa Volume 2 mol N2 jika diukur pada suhu 25 0C dan tekanan 1 atm?
Jawaban:
T = 250C + 273 = 298 K
![]() ;
; ![]() ; V = 48,87 Liter
; V = 48,87 Liter
Hubungan mol dengan koefisien
Berdasarkan rumusan mol dapat dijelaskan bahwa:
Perbandingan jumlah mol akan sama dengan perbandingan jumlah partikelnya
Misalnya:
1 Mol O2 : 2 Mol = 6,02 x 10 23 molekul O2 : 12,04 x 10 23 molekul O2
Perbandingannya sama yaitu 1 : 2
Telah dijelaskan pada hukum avogadro bahwa:
Perbandingan jumlah partikel akan sama dengan perbandingan koefisien.
Dari rumusan di atas diperoleh kesimpulan :
Perbandingan Mol = Perbandingan Koefisien
N2(g) + 3 H2(g) → 2NH3(g)
1 mol 3 mol 2 mol
atau
2 mol 6 mol 4 mol
Atau bisa dicari dengan rumus:

Contoh soal I:
Pada reaksi pembentukan gas amonia (NH3) dari gas nitrogen dan hidrogen digunakan 5 mol nitrogen, sesuai reaksi:
N2(g) + H2(g) → NH3(g) (belum setara)
Tentukan:
- Jumlah mol gas hidrogen
- Jumlah mol amonia (NH3)
Jawaban:
Langkah-langkah:
Setarakan persamaan reaksinya.
N2(g) + 3 H2(g) → 2NH3(g)
Tentukan mol yang dicari dengan perbandingan koefisien.
Mol yang diketahuinya adalah milik N2 sebanyak 5 mol.

Atau cara langsung:
N2(g) + 3 H2(g) → 2NH3(g)
5 mol 2/1 x 5 mol = 10 mol
Contoh soal II:
Jika 8,8 g C3H8 dibakar dengan gas oksigen dihasilkan sejumlah gas CO2 dan uap air.(Ar O =16) Tentukan Massa gas O2 yang diperlukan
Jawaban :
Langkah-langkah :
Setarakan Persamaan Reaksinya
C3H8 + 5O2 → 3CO2 + 4H2O
Ubah data yang yang diketahui di soal ke dalam bentuk mol
Diketahui di soal adalah massa C3H8 = 8,8 gr maka ubah ke bentuk mol dengan rumus:
![]() ;
; ![]() ; n = 0,2 mol
; n = 0,2 mol
Tentukan mol yang dicari dengan perbandingan koefisien.
Cara langsung:
C3H8 + 5O2 → 3CO2 + 4H2O
0,2 mol 5 / 2 x 0,2 = 0,5 mol
Jadi mol O2 adalah 0,5 mol
Ubah mol ke dalam bentuk yang di tanyakan
Di soal ditanyakan massa O2 dapat dicari dengan mengubah mol ke dalam bentuk massa dengan rumus:
Gram = n x Mr ; Gram = 0,5 x 32 ; Gram = 16 gram
Jadi massa O2 yang terbentuk adalah 16 gram
Contoh Soal & Pembahasan Konsep Mol & Stoikiometri Kelas 10
- P4
- Fe2(SO4)3
- Ca3(PO4)2
- KAl(SO4)2. 12H2O
- K4Fe(CN)6
PEMBAHASAN :
- Mr P4 = Ar P x 4 = 31 x 4 = 124
- Mr Fe2(SO4)3 = Ar Fe x 2 + Ar S x 3 + Ar O x 12 = 56 x 2 + 32 x 3 + 16 x 12 = 400
- Mr Ca3(PO4)2 = Ar Ca x 3 + Ar P x 2 + Ar O x 8 = 40 x 3 + 31 x 2 + 16 x 8 = 310
- Mr KAl(SO4)2. 12H2O = Ar K x 1 + Ar Al x 1 + Ar S x 2 + Ar O x 8 = 39 x 1 + 27 x 1 + 32 x 2 + 16 x 8 = 258
- Mr K4Fe(CN)6 = Ar K x 4 + Ar Fe x 1 + Ar C x 6 + Ar N x 6 = 39 x 4 + 56 x 1 + 12 x 6 + 14 x 6 = 368
PEMBAHASAN :
Mr L(OH)3 = Ar L x 1 + Ar O x 3 + Ar H x 3
78 = Ar L + 16 x 3 + 1 x 3
78 = Ar L + 51
Ar L = 78 – 51 = 27
PEMBAHASAN :
Menentukan rumus molekul
(Mr RE)n = Mr senyawa
(12 x 1 + 1 x 3)n = 30
(15)n =30
n = 30/15 = 2
maka rumus molekulnya : (CH3)2 = C2H6
- 2 gram gas H2 (Ar H = 1)
- 4 gram grafit (C) (Ar C = 12)
- 36 gram H2O (Ar H = 1, O = 16)
- 12,04 x 1022 molekul gas NH3 (ar N = 14, H =1)
- 3,01 x 1023 atom Pb (Ar Pb = 207)
- 1,204 x 1022 molekul S8 (Ar S = 32)
- 3,2 gram gas O2 diukur pada 27oC, 1 atm
- 4 gram gas SO3 diukur pada 27oC dan tekanan 380 mmHg (Ar S = 32, O = 16)
- 1,23 liter gas CH4 diukur pada 25oC dan tekanan 1 atm (Ar C = 12, H = 1)
- 10 liter gas butana (CH4) diukur pada 25oC dan tekanan 100 atm
PEMBAHASAN :
PEMBAHASAN :
PEMBAHASAN :
Menggunakan rumus:
%1. V1 = %2. V2
25.100 = 5.(100+x)
2500 = 500 + 5x
5x = 2000
x = 400 mL
- Molaritas larutan
- Fraksi mol larutan
PEMBAHASAN :
Rumus pengenceran
M1. V1 =M2. V2
12.V1 = 2. 500
V1 = 1.000/12 = 83,34 cm3
PEMBAHASAN :
2KClO3 → 2KCl + 3O2
Telah terbentuk 696 mL gas oksigen. Bila gas ini diukur pada keadaan di mana 0,58 liter gas nitrogen massanya 0,7 gram, hitunglah banyaknya kalium klorat yang telah terurai (Ar K = 39; Cl = 35,5; O = 16; N =14)
Fe + 2HCl → FeCl2 + H2
Hitunglah volume gas hidrogen yang dihasilkan, diukur pada 27oC, 1 atm (Ar Fe = 56)
Zn + 2HCl → ZnCl2 + H2
Jika gas hidrogen yang dihasilkan pada 0oC 1 atm adalah 2,24 liter, tentukan massa seng tersebut (Ar Zn = 65)
Zn + 2HCl → ZnCl2 + H2
Jika gas hidrogen yang dihasilkan pada 0OC 1 atm adalah 1,12 liter, tentukan kadar seng di dalam cuplikan tersebut (Ar Zn = 65)
Na + HCl → NaCl + H2
Al + HCl → AlCl3 + H2
Bila Ar Na = 23 dan Al = 27, tentukanlah:
- Massa masing-masing logam dalam campuran,
- Volume gas H2 yang dihasilkan pada reaksi tersebut diukur pada keadaan standar
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Setelah disaring, endapan yang dihasilkan dikeringkan dan ditimbang. Ternyata, massa endapannya adalah 1,165 gram. Jika Ar Ba = 137; Cl = 35,5; S = 32; O = 16; dan H = 1, tentukan jumlah air kristal di dalam kristal BaCl2 tersebut.
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung HCl 40 gram. Reaksi yang terjadi adalah:
Mg + HCl → MgCl2 + H2
Tentukan:
- Pereaksi pembatas
- Gas hidrogen yang dihasilkan, diukur pada 27oC, 1 atm
Logam bismuth dapat dibuat dari reaksi bismuth(III) oksida dengan karbon sesuai reaksi:
Bi2O3 + C → Bi + CO
Bila direaksikan 50 gram Bi2O3 dan 100 gram karbon, tentukan:
- Pereaksi pembatasnya,
- Massa logam Bi yang dihasilkan (Ar Bi = 208, O = 16, dan C = 12)
PEMBAHASAN :
Hitunglah massa Al(OH)3 yang dihasilkan bila 158 gram alumunium sulfida direaksikan dengan 131 gram air dengan persamaan reaksi:
Al2S3 + H2O → Al(OH)3 +H2S
Diketahui Ar Al =27, S = 32, H = 1, O = 16
Mangan dioksida yang massanya 72,5 gram direaksikan dengan 58,6 gram asam klorida hingga membentuk mangan (II) klorida, gas klorin, dan uap air
- Tuliskan persamaan reaksinya
- Tentukan pereaksi pembatasnya
- Berapa massa mangan (II) klorida yang dihasilkan?
- Berapa liter volume gas klorin yang dihasilkan, diukur pada 27oC, 1 atm?
- Berapa volume uap air yang dihasilkan jika 2 liter gas nitrogen mempunyai massa 2,8 gram?
Logam alumunium berlebihan direaksikan dengan 100 cm3 larutan asam sulfat 2 M dengan reaksi: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
- Berapa gram logam alumunium yang habis bereaksi dengan 100 mL larutan H2SO4 2 M tersebut
- Berapa liter gas hidrogen yang dapat dihasilkan dalam keadaan STP? (ArAl = 27)
Gas karbondioksida yang volumenya 6,72 (STP) liter dialirkan ke dalam larutan Ba(OH)2. Jika gas CO2 habis bereaksi, berapa gram endapan yang dihasilkan? (Ar Ba = 137; C = 12; O = 16) Reaksi yang terjadi : Ba(OH)2 + CO2 → BaCO3 + H2O
Ke dalam 200 cm3 larutan AgNO3 0,1 M ditambahkan 100 cm3 larutan NaCl 0,1 M. Jika diketahui Ar Ag = 108, dan Cl = 35,5 tentukan endapan maksimum yang dapat terjadi, jika reaksinya:
AgNO3 + NaCl → AgCl + NaNO3
Magnesium hidroksida (Mg(OH)2)dikenal sebagai bubur magnesia yang dapat dibentuk dari reaksi antara larutan natrium hidroksida dengan larutan magnesium klorida:
NaOH + MgCl2 → Mg(OH)2 + NaCl
Berapa cm3 larutan natrium hidroksida 0,3 M yang diperlukan agar tepat bereaksi dengan 75 cm3 larutan magnesium klorida 0,2 M dan berapa gram magnesium hidroksida maksimum dapat dihasilkan? (Ar Mg = 24, O = 16 dan H = 1)
Sumber Soal : Kelas X Penerbit Erlangga Pengarang Unggul Sudarmo
- 12 gram
- 18 gram
- 36 gram
- 9 gram
- 10 gram
Diketahui:
Massa kalsium = 18 gram
Massa kalsium oksida = 28 gram
Massa gas oksigen, misalkan = x
Menentukan massa gas oksigen sebagai berikut:
Massa kalsium + massa gas oksigen = massa kalsium oksida
18 gram + x = 28 gram
x = 28 gram – 18 gram
x = 10 gram
Maka massa gas oksigen = x = 10 gram
Jawaban E
- 3 : 4
- 5 : 2
- 7 : 20
- 10 : 7
- 2 : 5
Diketahui:
Ar N = 14
Ar O = 16
Maka perbandingan massa unsur N dan O sebagai berikut:
Massa N : massa O = (2 x Ar N) : (5 x Ar O)
= (2 x 14 ) : (5 x 16)
= 14 : 40
= 7 : 20
Jawaban C
- 18 liter dan 12 liter
- 24 liter dan 16 liter
- 16 liter dan 10 liter
- 28 liter dan 14 liter
- 30 liter dan 20 liter
Reaksi pembuatan amonia: N2(g) + 3H2(g) → 2NH3(g)
Berdasarkan hukum Gay Lussac:
Volume N2 : Volume H2 : Volume NH3 = 1 : 3 : 2
Maka volume gas nitrogen dan gas hidrogen dapat dihitung sebagai berikut:
Jawaban B
- 1 x 1024 molekul
- 1,204 x 1024 molekul
- 2,408 x 1024 molekul
- 3,612 x 1024 molekul
- 4,816 x 1024 molekul
Berdasarkan hipotesis Avogadro bahwa gas-gas yang bervolume sama pada suhu dan tekanan yang sama mengandung jumlah partikel yang sama.
Pada suhu dan tekanan yang sama, 12 liter gas nitrogen mengandung jumlah molekul yang sama dalam 12 liter gas oksigen. Jika 12 liter gas nitrogen mengandung 1,204 x 1024 molekul, maka jumlah molekul dalam 36 liter oksigen sebagai berikut:
Jawaban D
- Joseph Proust
- John Dalton
- Gay Lussac
- Amedeo Carlo Avogadro
- Antoine Laurent Lavoisier
Tokoh-tokoh hukum dasar kimia, diantaranya:
- Joseph Proust: hukum perbandingan tetap
- John Dalton: hukum perbandingan berganda
- Gay Lussac: hukum perbandingan volume
- Amedeo Carlo Avogadro: hukum avogadro
- Antoine Laurent Lavoisier: hukum kekekalan massa
Jawaban A
- 20
- 40
- 60
- 80
- 100
Diketahui:
Ar H = 1
Ar C = 12
Ar O = 16
Maka massa molekul relatif CH3COOH dapat dihitung sebagai berikut:
Mr CH3COOH = 2 . Ar C + 4 . Ar H + 2 . O
Mr CH3COOH = 2 . 12 + 4 . 1 + 2 . 16
Mr CH3COOH = 60
Jawaban C
- 0,2 mol
- 0,5 mol
- 1 mol
- 0,02 mol
- 0,05 mol
Diketahui:
Massa senyawa = 30 gram
Mr = 60
Maka jumlah mol CH3COOH dapat dihitung sebagai berikut:
Jawaban B
- 1 mol
- 2 mol
- 3 mol
- 4 mol
- 5 mol
Diketahui:
V = 67,2 liter
Maka jumlah mol gas NH3 dapat dihitung sebagai berikut:
Jawaban C
- 1,204 x 1023 atom
- 1,314 x 1023 atom
- 2,166 x 1023 atom
- 3,104 x 1023 atom
- 1,114 x 1023 atom
Diketahui:
n = 0,2 mol
L = 6,02 x 1023 atom/mol
Maka jumlah atom besi dapat dihitung sebagai berikut:
Jumlah atom besi = 0,2 mol x 6,02 x 1023 atom/mol
Jumlah atom besi = 1,204 x 1023 atom
Jawaban A
- 450 liter
- 510 liter
- 690 liter
- 780 liter
- 820 liter
Diketahui:
n = 10 mol
P = 200 mmHg = 0,3 atm
T = 27°C = 300 K
R = 0,082 L
Maka volume gas dapat dihitung sebagai berikut:
PV = n.R.T
0,3 x V = 10 x 0,082 x 300
0,3 x V = 246
V = 820 liter
Jawaban E
Ok demikian rangkuman materi dan contoh soal konsep mol & stoikiometri berikut video pembelajaran. Kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah, semoga materi ini berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.



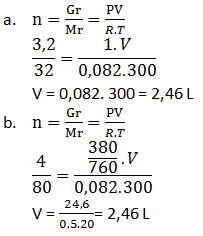

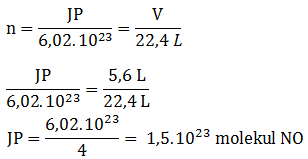


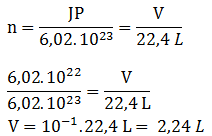






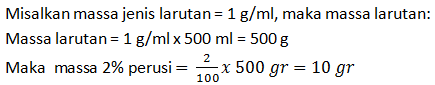
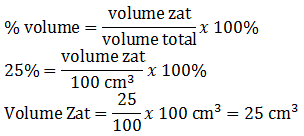
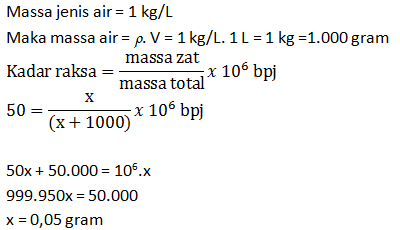
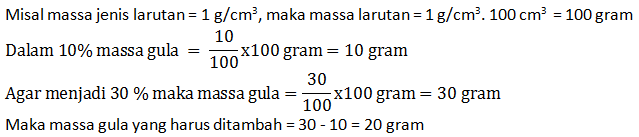



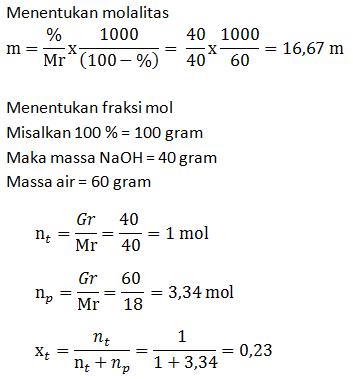
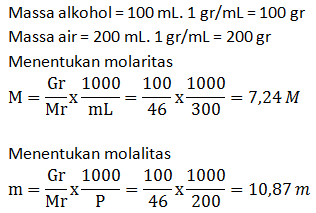


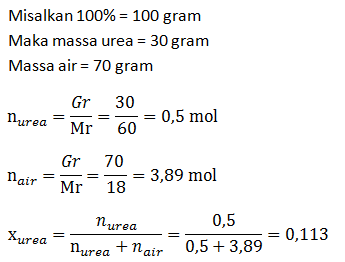
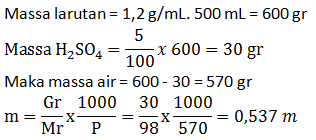
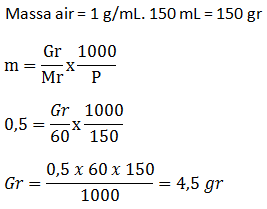

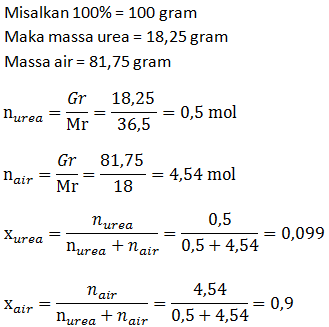




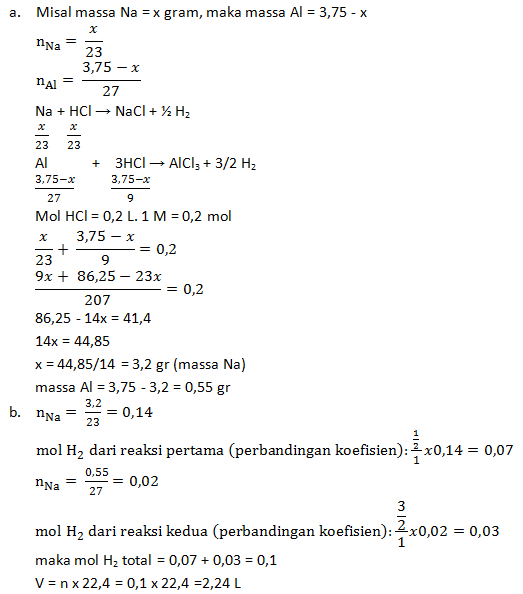
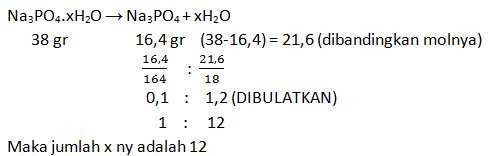












Terima kasihh ^^
Thanks yaaa, sangat bermanfaat ^^
Terimakasih, sangat membantu