Kali ini kita akan bahas bab laju reaksi yang membahas kecepatan suatu reaksi. Reaksi itu ada yang cepat ada juga yang lambat, apa pengertian laju reaksi dan apa faktor yang mempengaruhi laju reaksinya akan kita bahas disini. Untuk memahami bab ini kita kasih rangkuman materi dan contoh soal laju reaksi untuk kamu kelas 11. Selamat belajar
DAFTAR ISI
Rangkuman Materi Laju Reaksi Kelas 11
Pengertian Laju Reaksi
Menunjukkan perubahan konsentrasi zat yang terlibat dalam reaksi setiap satuan waktu.
pA + qB → rC + sD
Pereaksi Hasil reaksi
(Konsentrasi berkurang) (Konsentrasi bertambah)

Rumusan laju reaksi
- Untuk pereaksi:


Tanda (-) berarti berkurang
- Untuk produk:


Tanda (+) berarti bertambah
Hubungan Laju Reaksi dan Koefisien Reaksi
Laju reaksi suatu zat berbanding lurus dengan perbandingan koefisien reaksi zat tersebut
pA + qB → rC + sD
vA : vB : vC : vD = p : q : r : s
Persamaan Laju Reaksi
Menunjukan hubungan antara laju reaksi dengan konsentrasi pereaksi yang terlibat dalam reaksi. Hanya dapat ditentukan dari data hasil percobaan. Jika diketahui persamaan reaksi:
pA + qB → rC + sD
maka persamaan laju reaksinya:
v = k [A]x [B]y
v = laju reaksi ; k = konstanta laju reaksi
[A] = konsntrasi zat A (M) ; [B] = konsentrasi zat B (M)
x = orde reaksi zat A ; y = orde reaksi zat B
x+y = orde total reaksi.
Orde reaksi
- Reaksi Orde nol (v = k [A]0)

- Reaksi Orde satu (v = k [A])

- Reaksi Orde dua (v = k [A] [B] atau v = k [A]2)

Faktor-faktor yang mempengaruhi laju reaksi
Konsentrasi pereaksi
Semakin besar konsentrasi pereaksi, semakin cepat reaksi berlangsung/laju reaksi semakin besar. Karena semakin banyak zat yang bertumbukan.
Suhu
Semakin besar suhu reaksi, semakin cepat reaksi berlangsung/laju reaksi semakin besar. Karena energi kinetik zat yang bereaksi akan semakin besar untuk bertumbukan
Luas permukaan
Luas permukaan adalah besarnya permukaan yang dapat disentuh ketika bereaksi. Semakin besar luas permukaan, semakin cepat reaksi berlangsung/laju reaksi semakin besar.
Katalis
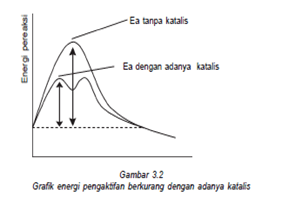
Katalis adalah zat yang ditambahkan untuk mempercepat reaksi dengan jalan mencari tahap dengan energi aktifasi yang lebih rendah. Katalis tidak ikut bereaksi karena di produk akan terbentuk kembali. Jenis katalis ada yang homogen ( wujud katalis dengan pereaksi sama) ada yang heterogen (wujud katalis dengan pereaksi berbeda).
Hubungan Kenaikan Suhu Terhadap Laju Reaksi
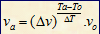
atau
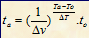
Va = laju reaksi pada suhu akhir (M/s)
Vo = laju reaksi pada suhu awal (M/s)
Ta = suhu akhir (oC)
To = suhu awal (oC)
Dv = kenaikan laju reaksi
DT = kenaikan suhu
ta = lama reaksi pada suhu akhir (s)
to = lama reaksi pada suhu akhir (s)
Teori tumbukan
- Agar dapat bereaksi partikel-partikel peraksi harus saling bertumbukan yang dipengaruhi oleh arah tumbukan dan frekuensi tumbukan .
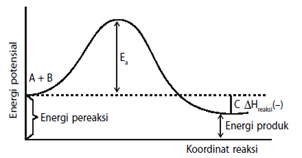
- Energi aktifasi (Ea) adalah energi kinetik minimum yang harus dimiliki oleh partikel pereaksi agar dapat bereaksi membentuk kompleks teraktivasi.
Contoh Soal Laju Reaksi Pembahasan & Jawaban
Apa yang di maksud dengan laju reaksi dan satuan dari laju reaksi ?
PEMBAHASAN :
Laju reaksi dinyatakan sebagai berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu. Satuannya dinyatakan sebagai mol dm-3 det-1 atau mol/liter detik
Zn(s) + 2HCI(aq) → ZnCI2 (aq) + H2(g)
Bagaimanakah rancangan percobaan yang akan Anda buat terkait dengan :
a. Zat yang akan diukur konsentrasinya.
b. Cara pengukurnya.
c. Alat yang digunakan.
d. Cara kerjanya.
PEMBAHASAN :
a. Zat yang akan diukur konsentrasinya yaitu gas H2
b. Cara mengukurnya dengan menghitung volume H2 yang dihasilkan per satuan waktu
c. alat yang digunakan untuk mengukur volume H2 yaitu silinder ukur yang dicelupkan ke dalam gelas kimia berisi air
d. Gas yang dihasilkan yaitu gas H2 akan mengisi ruang di silinder ukur yang berisi air yang kemudian menyebabkan adanya ruang kosong yang diukur volumenya.
N2(g) + 3H2(g) → 2NH3(g)
Setelah reaksi berlangsung selama 5 detik, ternyata masih tersisa 0,08 mol gas N2.
Tentukan laju reaksi sesaat berdasarkan:
Persamaan reaksi:
m 0,1 0,1 –
r 0,02 0,06 – 0,04 +
s 0,08 0,04 0,04

Tentukan :
a. Laju reaksi rata-rata dari gas A pada setiap selang waktu.
b. Laju reaksi rata-rata setiap selang waktu berdasarkan gas AB3 yang dihasilkan.
a. Selang waktu 0-5 detik
b. Selang waktu 0-5 detik
![]()
a. Berkurangnya gas NO2 tiap detik.
b. Bertambahnya gas N2O5 tiap detik.
PEMBAHASAN :
menentukan laju reaksi suatu zat dapat diperoleh dengan membandingkan koefisien dengan zat yang sudah diketahui laju reaksinya
a. ![]()
b. ![]()
PEMBAHASAN :
Persamaan laju reaksi yaitu persamaan yang menunjukan hubungan antara konsentrasi pereaksi dengan laju reaksi
PEMBAHASAN :
1. tidak bisa menentukan konsentrasi pereaksi saat reaksi sedang berjalan
2. ada kemungkinan reaksi berbalik arah, yaitu zat hasil reaksi kembali menjadi pereaksi
PEMBAHASAN :
Persamaan laju reaksinya v = k[A]0 atau v = k
satuan tetapan laju reaksinya yaitu mol/L detik atau M/s
NH4+(aq) + NO2–(aq) → N2(g) + 2H2O(l)
Adalah v = k [NH4+] [NO2–]. Pada suhu 25°C, nilai k = 3,0 x 10-4 mol-1 L detik-1.
Hitunglah laju reaksinya jika [NH4+] = 0,25 M dan [NO2–] = 0,02 M.
PEMBAHASAN :
v = k [NH4+] [NO2–]
v = 3,0 x 10-4 x 0,25 M x 0,02 M = 1,5 x 10-6 M/s

a. Dari data tersebut, tentukan orde reaksi terhadap HgCI2 dan C2O42- , serta orde reaksi keseluruhan.
b. Hitung nilai tetapan laju reaksinya (k).
c. Hitung laju reaksi jika konsentrasi awal HgCI2 0,02 mol/L dan C2O42- 0,22 mol/L.
a. menentukan orde HgCI2 (Cari 2 [C2O42-] yang sama yaitu percobaan 2 & 3)
Bandingkan percobaan 1 & 2
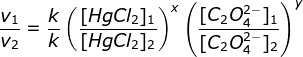
(karena k dan HgCI2 sama maka bisa dicoret)
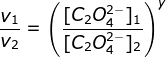
![]()
![]()
y = 2
Orde totalnya = x + y = 1 + 2 = 3
v = k [HgCl2]1[C2O42-]2 = 7,62 x 10-3 x (0,02)1 x (0,22)2 = 7,37 x 10-6 M/menit
PEMBAHASAN :
Faktor yang mempengaruhi laju reaksi diantaranya:
a. Luas permukaan
b. Konsentrasi pereaksi
c. Suhu
d. Katalis
PEMBAHASAN :
Semakin besar konsentrasi pereaksi, semakin besar jumlah partikel sehingga banyak peluang terjadinya tumbukan. Sehingga semakin banyak tumbukan, laju reaksinya semakin cepat
PEMBAHASAN :
akan lebih cepat dengan uap air, karena uap air memiliki luas permukaan yang lebih besar dibanding es atau air. Jika dengan uap air akan semakin banyak partikel yang bersentuhan dengan besi
PEMBAHASAN :
Jika suhu dinaikan, maka partikel akan bergerak lebih cepat yang menyebabkan energi kinetik partikel meningkat yang dapat menghasilkan tumbukan yang semakin sering sehingga laju reaksinya akan semakin cepat
PEMBAHASAN :
diketahui:
kenaikan laju reaksi (n) = 2
kenaikan suhu (ΔT) = 10°C
T1 = 20°C
T2 = 40°C
t20 = 30 menit
![]()
![]()

Berdasarkan tabel tersebut, perkirakan laju reaksi pada 5°C dan 50°C.
PEMBAHASAN :
diketahui:
kenaikan laju reaksi (n) = 2 ( dari suhu 20°C ke 25°C)
kenaikan suhu (ΔT) = 5°C ( dari suhu 20°C ke 25°C)
v20 = 0,1 x 10-3 menit
Menentukan laju reaksi pada 5°C jika dibandingkan laju reaksi pada suhu 20°C
T1 = 5°C
T2 = 20°C
![]()
![]()
![]()
Menentukan laju reaksi pada 50°C jika dibandingkan laju reaksi pada suhu 20°C
T1 = 20°C
T2 = 50°C
![]()
![]()
PEMBAHASAN :
Energi aktivasi yaitu energi minimal yang diperlukan untuk berlangsungnya suatu reaksi, katalis adalah suatu zat yang dapat mempercepat laju reaksi, tetapi tidak mengalami perubahan yang kekal. Hubungan antara katalis dan energi aktivitas dengan adanya katalis reaksi dapat menurunkan energi aktivasi
PEMBAHASAN :
dengan adanya katalis reaksi dapat lebih cepat dengan cara mengubah jalannya reaksi, dimana jalur reaksi yang ditempuh memiliki energi aktivasi yang lebih rendah
PEMBAHASAN :
Beberapa faktor yang mempengaruhi tumbuhan efektif kemungkinan tidak terpenuhi, seperti energi yang diperlukan untuk berlangsungnya reaksi kurang
PEMBAHASAN :
Pada pembuatan resin sering ditambahkan katalis untuk mempercepat terjadinya pembekuan resin.
Sumber Soal : Kimia Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo







Jawabannya no.10 bagian c yg mana yah?
Sudah kami tambahkan. Terima kasih koreksinya
Maaf untuk rumus hubungan kenaikan suhu terhadap laju reaksi ko kalau disini yang dipangkatin itu suhu awal-suhu akhir, tapi kalau di vidio (part 4) yang dipangkatin itu suhu akhir-suhu awal. Jadi yang benar yang mana ya? Terimakasih sebelumnya
akhir – awal yang benarnya. terima kasih koreksinya
Untuk soal no.2, itu kenapa zat yang diukur konsentrasi nya gas H2? Apa ada alasannya kenapa yang diukur H2?
yang diukur bisa semua zat. Namun kenapa gas H2 karena memiliki wujud gas yang dapat diukur volume gas yang diperoleh