Selanjutnya kita akan belajar bab larutan penyangga atau buffer. Di kehidupan kita banyak aplikasi dari adanya larutan ini beberapa diantaranya ada di dalam darah dan di dalam sel tubuh kita. Sekarang kita bantu buatkan rangkuman materi dan contoh soal larutan penyangga atau buffer untuk kelas 11. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini dan terakhir coba latihan soal larutan penyangga yah. Selamat belajar
DAFTAR ISI
Rangkuman Materi, 35 Contoh Soal & Pembahasan Larutan Penyangga / Buffer
Larutan yang dapat mempertahankan pH jika ditambah sedikit asam, basa atau air (pengenceran). Terdapat dua jenis:
Larutan Penyangga Asam
- Terbentuk dari Asam lemah & Basa Konjugasinya(dari garamnya)
- Rumus menentukan pH:

- Tipe Soal:
- Jika di soal diketahui asam lemah dan garamnya, caranya langsung masuk rumus.
- Jika di soal diketahui asam lemah dan basa kuat direaksikan dengan menggunakan metode m, r, s. Jika yang bersisa adalah asam lemah, berarti larutan buffer
- Contoh Soal
Tipe I
Hitunglah pH 100 mL CH3COOK 0,5 M dengan 200 mL CH3COOH 0,5 M (Ka CH3COOH = 1,7 x 10–5).
Jawab :

[H+] = 1,7 x 10–5 x 2 = 3,4 x 10-5
pH = 5 – log 3,4
Larutan Penyangga Basa
- Rumus Menentukan pH

- Terbentuk dari Basa lemah & Asam Konjugasinya(dari garamnya)
- Tipe Soal:
- Jika di soal diketahui basa lemah dan garamnya, caranya langsung masuk rumus.
- Jika di soal diketahui basa lemah dan asam kuat direaksikan dengan menggunakan metode m, r, s. Jika yang bersisa adalah basa lemah, berarti larutan buffer
- Contoh Soal
Tipe II
Hitunglah pH larutan jika 100 mL NH3(aq) 0,2 M dicampurkan dengan 100 mL HCl 0,1 M, Kb NH3(aq) = 1,8.10–5

Zat yang bersisa adalah basa lemah = penyangga basa

[OH–] = 1,8 x 10-5
pOH = 5 – log 1,8
pH = 14 – (5- log 1,8) = 9 + log 1,8
Contoh Soal & Pembahasan Larutan Penyangga / Buffer
- 100 mL larutan HCN 0,1 M + 50 mL larutan NaCN 0,2 M; Ka HCN = 4 x 10-5
- 50 mL larutan NH3 0,2 M + 100 mL larutan NH4Cl 0,1 M; Kb NH3 = 1 x 10-5
- 150 mL larutan CH3COOH 0,1 M + 100 mL larutan NaOH 0,1 M; Ka CH3COOH = 1 x 10-5
- 200 mL larutan NH3 0,1 M + 100 mL larutan HCl 0,1 M; Kb NH3 = 1 x 10-5
PEMBAHASAN :

PEMBAHASAN :

PEMBAHASAN :
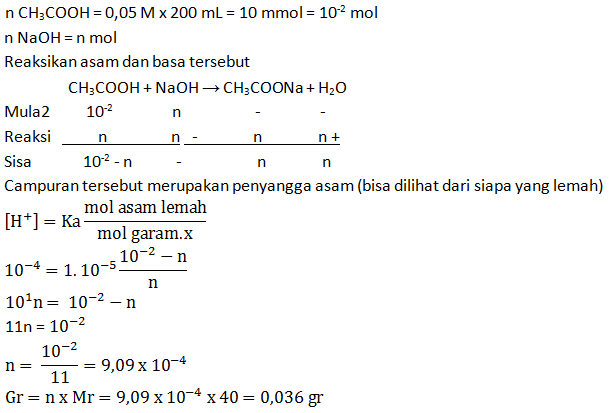
PEMBAHASAN :

PEMBAHASAN :
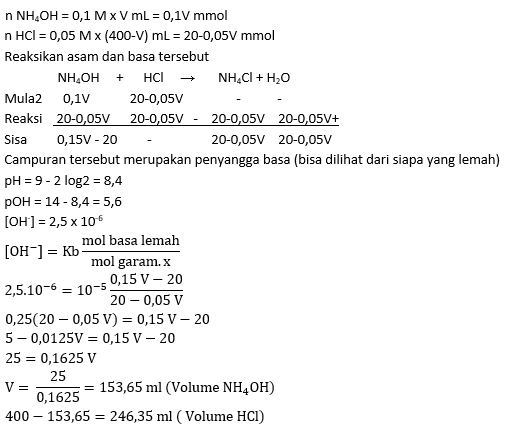
PEMBAHASAN :

PEMBAHASAN :

PEMBAHASAN :

PEMBAHASAN :

PEMBAHASAN :

PEMBAHASAN :


Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
- 100 ml NH3 0,1 M + 100 ml (NH4)2SO4 0,1 M
- 100 ml H3PO4 0,25 M + 100 ml NaH2PO4 0,25 M
- 100 ml H2SO4 0,05 M + 100 ml KOH 0,05 M
PEMBAHASAN :
- NH3 termasuk ke dalam basa lemah dan (NH4)2SO4 termasuk garam yang mengandung asam konjugasi NH3 yaitu NH4+ maka campuran tersebut termasuk larutan penyangga basa yang tersusun dari basa lemah NH3 dan asam konjugatnya yaitu NH4+
- H3PO4 termasuk ke dalam asam lemah dan NaH2PO4 termasuk garam yang mengandung basa konjugasi H3PO4 yaitu H2PO4− maka campuran tersebut termasuk larutan penyangga asam yang tersusun dari asam lemah H3PO4 dan basa konjugatnya yaitu H2PO4−
- H2SO4 termasuk ke dalam asam kuat dan KOH termasuk basa kuat campuran keduanya tidak akan menghasilkan larutan penyangga. Karena larutan penyangga salah satu komponennya harus berasal dari asam lemah atau basa lemah.
PEMBAHASAN :
(NH4)2SO4 merupakan garam yang mengandung asam konjugasi dari NH3 yang merupakan basa lemah. Basa lemah ketika dicampurkan dengan asam konjugasinya maka akan membentuk larutan penyangga basa. Jika diketahui pH larutan penyangga = 8, maka:
pH = 8
pOH = 14 – 8 = 6
[OH−] = 10-6
V basa lemah = 500 mL = 0,5 L
M basa lemah = 0,02 M
Rumus larutan penyangga basa:
![]()
valensi adalah jumlah ion asam konjugasinya yaitu NH4+ yaitu 2
![]()
![]()
Menentukan massa garam
Mr NH4)2SO4 = Ar N x 2 + Ar H x 8 + Ar S x 1 + Ar O x 4 = 14×2 + 1×8 + 32×1 + 16×4 = 28 + 8 + 32 + 64 = 132
Gr = n x Mr
Gr = 0,1 mol x 132 = 13,2 gram
- pH larutan tersebut
- pH larutan bila ke dalam larutan tersebut ditambahkan 10 ml larutan NaOH 0,25 M
- pH larutan bila kedalam larutan tersebut ditambahkan 10 ml larutan HCl 0,25 M
- pH larutan bila kedalam larutan tersebut ditambahkan 100 ml air
PEMBAHASAN :
- HCOOH merupakan asam lemah sedangkan HCOONa mengandung HCOO− yang merupakan basa konjugasi dari HCOOH sebagai campuran tersebut akan membentuk larutan penyangga asam. Maka pH campuran tersebut dihitung dengan menggunakan rumus larutan penyangga asam.
Mr HCOOH = Ar H x 2 + Ar C x 1 + Ar O x 2 = 1×2 + 12×1 + 16×2 = 46
Mr HCOONa = Ar H x 1 + Ar C x 1 + Ar O x 2 + Ar Na x 1 = 1×1 + 12×1 + 16×2 + 23×1 = 68




pH = 4 – log 3,24 - Ditambahkan 10 ml NaOH 0,25 M
NaOH akan menghailkan ion OH− yang akan bereaksi dengan HCOOH (asam)
n NaOH = M x V = 0,25 M x 10 ml = 2,5 mmol


pH = 4 – log 2 - Ditambahkan 10 ml HCl 0,25 M
HCl akan menghailkan ion H+ yang akan bereaksi dengan HCOO− (basa)
n HCl = M x V = 0,25 M x 10 ml = 2,5 mmol


pH = 4 – log 5,4 - Penambahan air atau pengenceran tidak akan mengubah mol asam lemah dan basa konjugatnya. Sehingga nilai pH nya akan sama dengan pH pertama yaitu 4-log 3,24
Campuran yang terdiri dari CH3COOH 0,2 M dan NaOH 0,1 M membentuk 150 ml larutan penyangga dengan pH = 5. Jika Ka CH3COOH = 10-5 tentukan volume masing-masing dari larutan CH3COOH dan NaOH yang digunakan!
PEMBAHASAN :
CH3COOH merupakan asam lemah sedangkan NaOH merupakan basa kuat. Agar membentuk larutan penyangga dengan pH = 5 (penyangga asam), maka basa kuat harus habis (pereaksi pembatas). Jika dimisalkan:
V CH3COOH = V1
V NaOH = 150 – V1 (karena totalnya 150 ml)
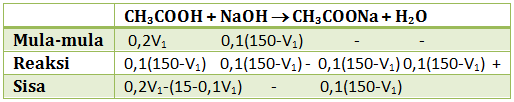
pH = 5
maka [H+] = 10-5
![]()
![]()
15 – 0,1V1 = 0,6V1 -30
0,7 V1 = 45
V1 = 45/0,7 = 64,285 ml
V CH3COOH = 64,285 ml
V NaOH = 150 – 64,285 ml = 85,714 ml
Sejumlah 100 ml HA 0,04 M (Ka = 1.10-9) dititrasi dengan larutan KOH 0,01 M. pH saat dititrasi dengan 100 ml KOH adalah….
PEMBAHASAN :
Diketahui:
n HA = M x V = 0,04 M x 100 ml = 4 mmol
n KOH = M x V = 0,01 M x 100 ml = 1 mmol

Karena yang bersisa adalah HA yang merupakan asam lemah karena memiliki Ka, maka terbentuk larutan penyangga
![]()
![]()
pH = 9 – log 3
- 1,5
- 4
- 5
- 8,5
- 10
PEMBAHASAN :
n C6H5OH = M x V = 0,1 M x 30 ml = 3 mmol
n NaOH = M x V = 0,1 M x 15 ml = 1,5 mmol
Jika dituliskan dalam reaksi:

Karena yang bersisa adalah asam lemah dan garamnya, maka hasil reaksinya menghasilkan larutan penyangga asam
![]()
Jika diencerkan menjadi 100 ml maka
n C6H5OH menjadi
M1.V1 = M2.V2
n C6H5OH = M2.V2
1,5 mmol = M2.100 ml
![]()
n C6H5O− menjadi
M1.V1 = M2.V2
n C6H5O– = M2.V2
1,5 mmol = M2.100 ml
![]()
maka setelah pengenceran pH nya menjadi:
![]()
Jawaban E
Soal No.19 (SBMPTN 2017)
- 10-5
- 10-4
- 10-2
- 10-1
- 10
PEMBAHASAN :
Asam hipobromit yang merupakan asam lemah ketika direaksikan dengan basa konjugasinya (garamnya) maka akan membentuk larutan penyangga asam.
Jika pH = 10, maka nilai [H+] = 10-10, perbandingan ![]() dapat ditentukan dari rumusan penyangga
dapat ditentukan dari rumusan penyangga
[H+] = Ka x ![]()
![]()
Jawaban D
- 3 + log 2
- 10 – 2 log 2
- 10 – log 2
- 10 + 2 log 2
- 9 + log 2
PEMBAHASAN :
Reaksi antara NaOH dengan HCN
n HCN = 0,15 mol
n NaOH = 0,1 mol

Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
![]()
(x = jumlah basa konjugasi)
volume diabaikan karena dilakukan pada volume yang sama
pH = 10 – log 2
Jawaban C
- 4 + log 5
- 6 – log 2
- 6 + log 2
- 8 – log 2
- 10 + log 5
PEMBAHASAN :
Reaksi antara asam hipoklorit (HClO) dengan NaOH
n HClO = M x V = 100 mL x 0,1 M = 10 mmol
n NaOH = M x V = 100 mL x 0,05 M = 5 mmol

Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
![]()
(x = jumlah basa konjugasi)
pH = 8 – log 2
Jawaban D
- 2
- 4
- 10 – log 5
- 10
- 12
PEMBAHASAN :
Reaksi antara HCN dengan KOH
n HCN = M x V = 0,30 M x 200 mL = 60 mmol
n KOH = M x V = 0,30 M x 100 mL = 30 mmol

Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam.
Ketika di tambah 0,8 gr NaOH pada campuran maka OH− dari NaOH akan bereaksi dengan HCN membentuk CN−
![]()

![]()
pH = 10
Jawaban D
- 2
- 3
- 4
- 5
- 6
PEMBAHASAN :
Reaksi antara CH3COOH dengan NaOH
n CH3COOH = 0,6 mol
n NaOH = 0,2 mol

Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
![]()
(x = jumlah basa konjugasi)
volume diabaikan karena dilakukan pada volume yang sama
pH = 4
Jawaban C
- 2 x 10-10 M
- 2 x 10-7 M
- 2 x 10-6 M
- 5 x 10-5 M
- 7 x 10-4 M
PEMBAHASAN :
Karena dibentuk dari HNO2 dan NaNO2 maka buffer tersebut merupakan buffer asam
pH = 8, maka [H+] = 10-8, Jika diketahui mol NaNO2 = 1 mmol, maka mol HNO2 adalah
![]()
![]()
![]()
Maka molaritas HNO2
![]()
Jawaban C
- buffer dengan pH 5
- buffer dengan pH 6
- buffer dengan pH 9
- garam terhidrolisis dengan pH 5
- basa dengan pH 9
PEMBAHASAN :
Reaksi antara asam hipoklorit (HClO) dengan NaOH
![]()
n CH3COOH = M x V = 0,1 M x 500 mL = 50 mmol

Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
![]()
(x = jumlah basa konjugasi)
pH = 5
Jawaban A
- 5 – log 3,6
- 5 – log 3,2
- 4 – log 7,2
- 4 – log 3,6
- 4 – log 1,8
PEMBAHASAN :
n HCOOH = M x V = 0,01 M x 100 mL = 1 mmol
n HCOONa = M x V = 0,005 M x 100 mL = 0,5 mmol
Jika ditambahkan air sampai volume 200 mL, maka molaritas zat menjadi
![]()
![]()
Karena terdiri dari asam lemah dan garamnya maka akan terbentuk larutan penyangga asam
Menentukan pH nya dengan rumus penyangga asam
![]()
(x = jumlah basa konjugasi)
pH = 4 – log 3,6
Jawaban D
- 50 mL CH3COOH 0,2 M dan 50 mL NaOH 0,1 M
- 50 mL CH3COOH 0,2 M dan 100 mL NaOH 0,1 M
- 50 mL HCl 0,2 M dan 100 mL NH3 (aq) 0,1 M
- 50 mL HCl 0,2 M dan 50 mL NH3 (aq) 0,1 M
- 50 mL HCl 0,2 M dan 50 mL NaOH 0,1 M
PEMBAHASAN :
Jika akan membentuk larutan penyangga maka mol asam lemah atau basa lemah harus lebih besar dibanding basa kuat atau asam kuatnya. Pada pilihan A mol CH3COOH (asam lemah) = 0,2 M x 50 mL = 10 mmol lebih besar dibandingkan mol NaOH (basa kuat) = 0,1 M x 50 mL = 5 mmol. Sehingga yang bersisa nanti adalah asam lemah dengan garamnya yang akan membentuk larutan penyangga asam
Jawaban A
- 100 mL NaOH 0,1 M + 100 mL HCl 0,1 M
- 100 mL NaOH 0,1 M + 100 mL NaCN 0,1 M
- 100 mL NaCN 0,1 M + 100 mL HCN 0,1 M
- 100 mL NH4OH 0,1 M + 100 mL H2SO4 0,1 M
- 100 mL K2SO4 0,1 M + 100 mL H2SO4 0,1 M
PEMBAHASAN :
Untuk dapat membentuk larutan penyangga bisa dengan dua cara
- Asam lemah dengan garam yang mengandung basa konjugasinya atau Basa lemah dengan garam yang mengandung asam konjugasinya.
- Asam lemah dengan basa kuat dengan mol asam lemah bersisa atau basa lemah dengan asam kuat dengan mol basa lemah bersisa.
Jika dilihat dari pilihan jawabannya
- 100 mL NaOH 0,1 M + 100 mL HCl 0,1 M. Bukan larutan penyangga karena kedua moal asam dan basa sama (hidrolisis)
- 100 mL NaOH 0,1 M + 100 mL NaCN 0,1 M. Bukan larutan penyangga karena terdiri dari basa kuat dan asam konjugasinya.
- 100 mL NaCN 0,1 M + 100 mL HCN 0,1 M. Termasuk larutan penyangga karena terdiri dari asam lemah (HCN) dan basa konjugasinya (CN–).
- 100 mL NH4OH 0,1 M + 100 mL H2SO4 0,1 M. Bukan larutan penyangga karena yang bersisa adalah asam kuat.
- 100 mL K2SO4 0,1 M + 100 mL H2SO4 0,1 M. Bukan larutan penyangga karena terdiri dari asam kuat dan basa konjugasinya.
Maka jawaban yang tepat adalah C
Jawaban C
- 100 mL
- 150 mL
- 200 mL
- 250 mL
- 300 mL
PEMBAHASAN :
Diketahui:
pH = 9, maka pOH = 14 – 9 = 5
sehingga [OH–] = 10-5 M
n NH4OH = M x V = 0,2 M x V = 0,2V mmol
n HCl = M x V = 0,1 M x 100 mL = 10 mmol
Menentukan volume NH4OH yang ditambahkan dengan metode m,r,s
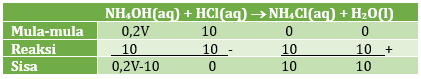
HCl habis karena pH = 9 (basa) sehingga membentuk larutan penyangga basa karena basa lemah yang bersisa.
![]()
![]()
10 = 0,2V – 10
0,2V = 20
V = 200 mL
Jawaban C
- 1 : 1
- 1 : 2
- 1 : 3
- 2 : 1
- 2 : 3
PEMBAHASAN :
Diketahui:
pH = 6 − log 5, maka [H+] = 5.10-6 M
Menentukan perbandingan volume
![]()
![]()
Karena molaritasnya sama, maka
![]()
Maka perbandingan volumenya adalah = 1 : 2
Jawaban B

- P dan Q
- Q dan R
- R dan S
- R dan T
- S dan T
PEMBAHASAN :
Larutan penyangga atau buffer yaitu larutan yang dapat mempertahankan pH ketika ditambah sedikit asam, sedikit basa atau pengenceran. Dari data tabel larutan yang sedikit berubah pHnya ketika ditambah sedikit asam dan sedikit basa adalah larutan Q dan R
Jawaban B
- 3 – log 2
- 5 – log 2
- 2 – log 3
- 3 – log 5
- 5 – log 3
mmol CH3COOH = 200 ml x 0,1 M = 20 mmol
mmol CH3COONa = 100 ml x 0,1 M = 10 mmol
Maka pH campuran dapat dihitung sebagai berikut:
[H+ ] = 2 x 10-5
pH = – log [H+ ] = – log 2 x 10-5 = 5 – log 2
Jawaban B
- H2CO3
- Hb4O8
- HCN
- H2PO4
- H2SO4
PEMBAHASAN :
Larutan penyangga dalam air ludah adalah H2PO4/HPO42- , yang berfungsi menjaga mulut pada pH sekitar 6,8. Sehingga dapat menetralkan asam-asam yang terbentuk dari fermentasi sisa-sisa makanan.
Jawaban D
- Campuran asam lemah dan basa lemah
- Campuran asam kuat dan garamnya
- Campuran asam lemah dan garamnya
- Campuran basa kuat dan garamnya
- Campuran basa kuat dan asam kuat
PEMBAHASAN :
Larutan penyangga dapat dibentuk dari campuran asam lemah dengan garamnya (basa konjugasinya) atau campuran basa lemah dengan garamnya (asam konjugasinya).
Jawaban C
- 150 ml
- 100 ml
- 70 ml
- 50 ml
- 30 ml
Diketahui:
mol CH3COOH = 100 ml x 0,4 M = 0,4 mmol
pH = 4 → [H+ ] = 10-4
![]()
![]()
0,04 V = 4
V = 100 ml
Jawaban B
- Asamnya lemah
- Basanya lemah
- pH nya netral
- Mengalami disosiasi
- pH nya tidak mudah berubah
PEMBAHASAN :
Pada larutan penyangga (buffer) harga pH nya tidak mudah berubah/ dapat mempertahankan pH dengan penambahan sedikit asam atau sedikit basa (pengenceran). Hal ini merupakan ciri khas dari larutan penyangga.
Jawaban E
Latihan Soal Larutan Penyangga/Buffer
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Gimana belajar larutan penyangga nya, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Ok demikian rangkuman materi dan contoh soal larutan penyangga atau buffer berikut video pembelajaran dan latihan soalnya. Semoga berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.






Mas,
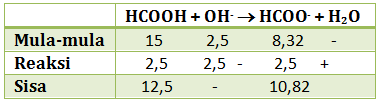
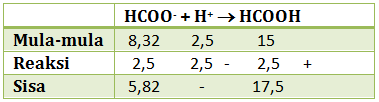
Itu yg no. 1 c seharusnya 6-log2 mas, klo jawaban saya
6 – log 2 nya dapat dari mana?