Lanjut lagi belajar bab kelarutan dan Ksp. Di bab ini kita akan membahas zat-zat yang sukar larut jika dimasukan ke dalam air. Bagaimana kelarutannya supaya lebih jelas kita bantu buatkan rangkuman materi dan contoh soal kelarutan dan Ksp buat kamu kelas 11. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini dan terakhir coba latihan soal kelarutan dan Ksp yah. Selamat belajar
DAFTAR ISI
Rangkuman Materi Kelarutan & Ksp Kelas 11
- Kelarutan/Solubility (s) merupakan jumlah atau konsentrasi maksimum zat yang dapat larut dalam sejumlah pelarut. Kelarutan setiap zat memiliki harga yang berbeda-beda.
- Zat-zat yang sukar larut jika dilarutkan akan mengalami reaksi kesetimbangan antara zat padat yang tidak larut dan ion-ion yang larut. Contoh:
MA(s)
 M+(aq) + A− (aq)
M+(aq) + A− (aq)
- Karena reaksinya berupa reaksi kesetimbangan maka akan memiliki tetapan kesetimbangan yang disebut tetapan hasil kali kelarutan (sulobility product constant) dan dilambangkan Ksp.
- Persamaan Ksp untuk MA dapat dituliskan:Ksp = [M+].[A–]
Hubungan Kelarutan dan Ksp
Kelarutan dapat dihitung dari nilai Ksp begitu pula sebaliknya
Menentukan Ksp dari kelarutan
Misalnya jika konsentrasi Ag2SO4 adalah s maka cara menentukan Ksp nya adalah sebagai berikut:
Ag2SO4 ![]() 2Ag+ + SO42-
2Ag+ + SO42-
. s 2s s
(menentukan konsentrasi ion-ionnya menggunakan prinsip stoikiometri/perbandingan koefisien)
Ksp = [Ag+]2 . [SO4]2-
Ksp = (2s)2. (s) = 4s2. s = 4s3
Jadi nilai Ksp nya adalah 4s3
Contoh Soal:
Hitung Ksp Ag2CO3 jika kelarutan Ag2CO3 dalam air pada suhu 25oC adalah 10-4 mol/L.
Jawaban :
Ag2CO3 ![]() 2Ag+ + CO32-
2Ag+ + CO32-
. s 2s s
Ksp = [Ag+]2 . [SO4]2-
Ksp = (2s)2. (s)
Ksp = 4s2. s
Ksp = 4s3
Ksp = 4.(10-4)3
Ksp = 4.10-12
Menentukan Kelarutan dari Ksp
Contoh Soal:
Jika Ksp CaCO3 = 2,5 x 10-9, berapakah nilai kelarutannya!
Jawaban
CaCO3 ![]() Ca2+ + CO32-
Ca2+ + CO32-
. s s s
Ksp = [Ca2+]. [CO32-]
Ksp = s . s
Ksp = s2
s = ![]() =
= ![]() = 5 x 10-5 mol/L
= 5 x 10-5 mol/L
Perkiraan Pengendapan
Harga Ksp dapat digunakan untuk menentukan apakah suatu zat elektrolit dapat larut atau mengendap. Harga Ksp adalah batas jumlah zat yang ditambahkan agar tetap larut. Jika zat yang ditambahkan (konsentrasinya) melebihi Ksp maka tidak akan larut lagi.
Penentuannya dapat menggunakan prinsip:
Contoh : Larutan MA
MA ![]() M+ + A−
M+ + A−
Jika [M+] . [A−] < Ksp, larutan dikatakan belum jenuh (tak terjadi endapan).
Jika [M+] . [A−] = Ksp, larutan dikatakan tepat jenuh (tak terjadi endapan).
Jika [M+] . [A−] > Ksp, larutan dikatakan lewat jenuh (terjadi endapan).
Pengertian:
- Larutan belum jenuh : larutan yang jumlah zat terlarutnya masih kurang dari jumlah zat maksimum yang dapat larut. Belum diperoleh endapan.
- Larutan jenuh/tepat jenuh : larutan yang jumlah zat terlarutnya maksimum untuk dapat larut. Belum diperoleh endapan
- Larutan lewat jenuh : Larutan yang jumlah zatnya melebihi jumlah maksimum yang dapat larut. Ditandai dengan adanya endapan.
Pengaruh Ion Senama
Contoh soal:
Diketahui Ksp CaCO3 = 4,8.10-9.
- Berapakah kelarutan CaCO3 dalam air?
- Berapa kelarutan CaCO3 dalam satu liter larutan yang mengandung CaCl2 0,15 mol?
- Misal kelarutan CaCO3 dalam air = X mol L–1
CaCO3(s) Ca2+(aq) + CO32–(aq)
Ca2+(aq) + CO32–(aq)
Ksp CaCO3 = [Ca2+][CO32-] 4,8.10-9 = (X) x (X) = X2
X = √4,8 . 10-9
X = 6,9.10-5
Kelarutan CaCO3 dalam air adalah = 6,9.10-5 mol L–1 - Misal kelarutan CaCO3 dalam CaCl2 = X mol L–1
CaCO3(s) Ca2+(aq) + CO32–(aq)
Ca2+(aq) + CO32–(aq)
(X + 0,15) mol X mol
Ca2+ dari CaCl2 = 0,15 mol. Nilai ini jauh lebih besar dari nilai Ca2+ dan CaCO3
sehingga (X + 0,15) ~ 0,15 mol
Ksp CaCO3 = [Ca2+][CO32–] 4,8.10-9 = (0,15) x (X)
X = 4,8.10-9 / 0,15
= 3,2.10-8
Jadi, kelarutan CaCO3 dalam larutan CaCl2 0,15 M = 3,2.10-8 mol L–1, ini lebih kecil 3.000 kali dibandingkan dengan kelarutan dalam air.
Hubungan harga Ksp dan pH
Contoh soal:
Kelarutan L(OH)2 dalam air sebesar 5 x 10-4 mol L-1, maka larutan jenuh L(OH)2 dalam air memiliki pH sebesar..
Mencari [OH–]
L(OH)2 ![]() L2+(aq) + 2OH−(aq)
L2+(aq) + 2OH−(aq)
5 x 10-4 M 5 x 10-4 M 2 x 5 x 10-4 M
10-3 M
[OH−] = 10-3 M
pOH = 3
pH = 14 – 3 = 11
Contoh Soal & Pembahasan Ksp & Kelarutan Kelas 11
PEMBAHASAN :
- Jenis pelarut, sifat polar dan non polar mempengaruhi kelarutan. Senyawa polar akan larut pada senyawa polar. Sedangkan senyawa non polar hanya akan larut pada senyawa non polar
- Suhu, saat suhu dinaikan, jarak antar molekul zat padat semakin renggang sehingga ikatannnya semakin lemah sehingga menjadi mudah larut dalam air. Sedangkan wujud gas naiknya suhu menjadi kurang larut karena gas akan mudah terlepas pada saat suhu dinaikan
- Ag2CrO4
- Cu2S
- PbI2
- Ca(OH)2
- CdS
Soal No.3
Jika diketahui kelarutan gula adalah 1.800 gram/liter dan Mr gula = 360, tentukan kelarutan gula dalam satuan mol/liter
PEMBAHASAN :
PEMBAHASAN :
AxBy ⇌ xAy+ + yBx-
s xs ys
Ksp = [Ay+]x[Bx-]y
Ksp = xsx. ysy
Ksp = xx.yy.s(x+y)
PEMBAHASAN :
PbI2 ⇌ Pb2+ + 2I–
s s 2s
Ksp = [Pb2+][I–]2
Ksp = s.(2s)2 = 4s3
Ksp = 4(1 x 10-4)3 = 4. 10-12
PEMBAHASAN :
- Larutan NaOH 0,001 M
- Larutan NiCl2 0,001 M
- Larutan yang mempunyai pH = 11
- Larutan yang berisi NH3 0,1 M dan NH4Cl 0,1 M (Kb NH3= 10-5)
PEMBAHASAN :
Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
- 1,21 mol/liter
- 2,46 mol/liter
- 1,54 mol/liter
- 3,01 mol/liter
- 2,11 mol/liter
Menghitung kelarutan BaSO4 sebagai berikut:
Kelarutan BaSO4 dalam mol/liter dapat dihitung sebagai berikut:
Jawaban A
- 8
- 9
- 10
- 11
- 12
Diketahui:
s L(OH)2 = 5 x 10-5 M
L(OH)2 ⇔ L2+ + 2OH¯
5 x 10-5 2 x 5 x 10-5
Maka pH larutan jenuh L(OH)2 sebagai berikut:
[OH¯] = 2 x 5 x 10-5 = 10-4
pOH = – Log [OH¯] = – Log 10 – 4 = 4
pH = 14 – pOH = 14 – 4 = 10
Jawaban C
- 1,5 x 10-4 mol/liter
- 2 x 10-4 mol/liter
- 2,2 x 10-4 mol/liter
- 1,1 x 10-4 mol/liter
- 0,3 x 10-4 mol/liter
Diketahui:
massa CaF2 = 9,6 mg = 9,6 x 10-3 g
massa molar CaF2 = 78 g/mol
Volume larutan CaF2 = 600 ml = 0,6 liter
Menentukan jumlah mol CaF2 sebagai berikut:
Jawaban B
- Tidak jenuh
- Tepat jenuh
- Lewat jenuh
- Tidak mengendap
- Netral
Diketahui:
[Pb2+ ] = 0,04 M
[Cl¯] = 0,04 M
Menentukan nilai Qc dari larutan PbCl2 sebagai berikut:
Qc = [Pb2+ ] [Cl¯]²
Qc = 0,04 x (0,04)²
Nilai Qc > Ksp PbCl2 maka larutan PbCl2 berada pada kondisi lewat jenuh dan akan mengendap.
Jawaban C
- 9,11
- 11,98
- 13,75
- 15,42
- 17,64
Diketahui:
V = 400 ml = 0,4 liter
s = 1,5 x 10-4 mol/liter
Ar Pb = 206; S = 32; O = 14
Mr PbSO4 = 294
Menentukan jumlah mol PbSO4 sebagai berikut:
n = 1,5 x 10-4 mol/liter x 0,4 liter
n = 0,6 x 10-4 mol
Maka massa PbSO4 (mg) dapat dihitung sebagai berikut:
Gram = n x Mr
= 0,6 x 10-4 x 294
= 176,4 x 10-4
= 17,64 mg
Latihan Soal Kelarutan & Ksp Kelas 11
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Ok demikian pembahasan mengenai bab kelarutan dan Ksp, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Semoga bermanfaat yah rangkuman materi dan contoh soal hidrolisis berikut video pembelajaran dan latihan soalnya. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.
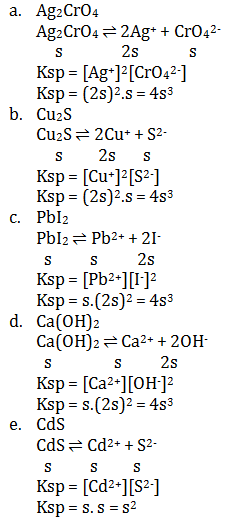

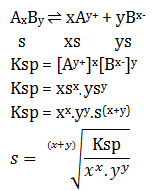
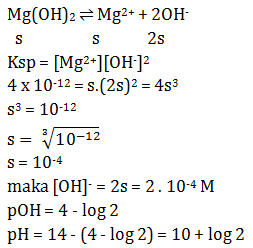
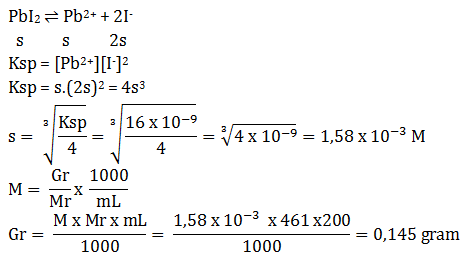
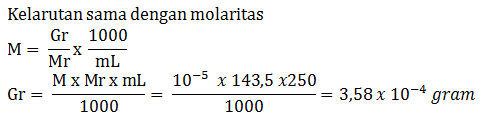
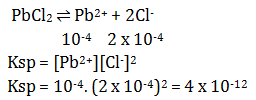












Pembahasannya jelas, desainnya rapi dan menarik. Sangat membantu buat belajar! Trims
Sangat membantu, sudah seperti tempat les bagi saya 😀