Update Terbaru? Gabung Disini : facebook_accounttwitter_accountgoogle_plus_accountyoutube_account
Rangkuman Materi Termokimia, Reaksi Endoterm, Eksoterm
Rangkuman Materi Termokimia
- Sistem dan Lingkungan
Sistem : Segala sesuatu yang menjadi pusat perhatian/ pengamatan.
Lingkungan : Bagian di luar sistem.
Perbedaan Reaksi Endoterm & Eksoterm
|
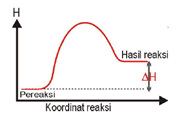
Reaksi Endoterm |
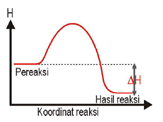
Reaksi Eksoterm |
|
Terjadi perpindahan kalor dari lingkungan ke sistem (sistem menyerap kalor dari lingkungan). |
Terjadi perpindahan kalor dari sistem ke lingkungan (sistem melepas kalor ke lingkungan). |
| ΔH = + atau ΔH > 0 |
ΔH = - atau ΔH < 0 |
 |
 |
DOWNLOAD RANGKUMAN TERMOKIMIA DALAM BENTUK PDF Klik Disini
Perubahan Entalpi Standar (ΔH0)
Jenis-jenis perubahan entalpi standar:
Perubahan entalpi pembentukan standar (ΔH0f)
Perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil.
Unsur-unsur stabil :
|
Monoatomik |
Diatomik |
Poliatomik |
|
Gol I A, Gol, IIA, Gol Transisi, Gol VIII A, C, Pb, S |
F2, Cl2, Br2, I2, H2, O2, N2 |
P4, S8
|
Contoh pembentukan air:
H2 (g) + ½O2 (g) → H2O (l) ΔH = -285,5 kJ
LIHAT JUGA : Video Pembelajaran Termokimia
Perubahan entalpi penguraian standar (ΔH0d)
Perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil. Contoh Penguraian C2H6 :
C2H6 (g) → 2C (s) + 3 H2 (g) ΔH = -x kJ
Perubahan entalpi pembakaran standar (ΔH0c)
Perubahan entalpi yang terjadi pada pembakaran 1 mol suatu senyawa menjadi CO2 (pembakaran sempurna)/CO(pembakaran tidak sempurna) dan H2O. Contoh Pembakaran CH4
CH4(g) + 4O2 (g)→ CO2 (g) + 2H2O (l) ΔH = +x kJ
[symple_spacing size=”30″]
LIHAT JUGA : Contoh Soal & Pembahasan Termokimia
Persamaan Termokimia
Persamaan reaksi yang menunjukkan informasi DH . Didalam persamaan termokimia :
Koefisien = Mol
Contoh :
H2 (g) + ½ O2 (g) → H2O (l) ΔH = -285,5 kJ
Dibaca :
1 mol gas hidrogen bereaksi dengan ½ mol gas oksigen menghasilkan air dengan melepaskan kalor sebesar 285,5 kJ
Perhitungan Persamaan Termokimia Berlaku :
- Jika reaksi dibalik, nilai ΔH berubah tanda dari + ke – dan sebaliknya.
- Jika reaksi dikali x, maka nilai ΔH dikali x.
- Jika reaksi dibagi x, maka nilai ΔH dibagi x.
Cara 1 : Percobaan
Alat yang digunakan adalah kalorimeter. Percobaan biasanya dilakukan pada tekanan tetap. Pada tekanan tetap terjadi perpindahan kalor antara sistem dan lingkungan, yaitu:
qreaksi = - (qsistem + qkalorimeter)
qsistem = m . c . ΔT
qkalorimeter = C . ΔT
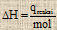
m = massa zat (gram)
c = kalor jenis (J/g 0C)
C = kapasitas jenis (J/0C)
ΔT = Perubahan suhu
Cara 2 : Hukum Hess
Kalor reaksi pada suatu reaksi tidak bergantung pada jalannya reaksi, tetapi hanya bergantung pada keadaan awal dan akhir reaksi
Atau
Perubahan entalpi suatu reaksi tetap sama, baik
berlangsung dalam satu tahap maupun beberapa tahap
Cara 3 : Penentuan ΔHreaksi dari data ΔH0f
ΔHreaksi = (ΣΔH0f produk - ΣΔH0f pereaksi)
Contoh :
pA + qB ® rC + sD DHr = ……?
ΔHreaksi = (ΔH0f C x r + ΔH0f D x s) - (ΔH0f A x p + ΔH0f B x q)
Cara 4 : Penentuan DHreaksi dari data Energi Ikatan
Penentuan ΔHreaksi dari data energi ikatan dapat ditentukan dengan rumus:
ΔHreaksi = (Energi total pemutusan ikatan – Energi total pembentukan ikatan)
[symple_spacing size=”15″]
DOWNLOAD RANGKUMAN TERMOKIMIA DALAM BENTUK PDF Klik Disini
terimakasih banyak mas.. akhirnya bisa sedikit mengerti 🙂