Contoh Soal & Pembahasan Asam Basa & Titrasi SBMPTN Kimia SMA
Sebanyak 25 ml larutan metilamina (CH3NH2) 0,04 M (Kb = 4 x 10-4) dititrasi dengan larutan HCl 0,02 M
pH larutan CH3NH2 sebelum dititrasi adalah….
- 3 - 2 log 2
- 5 - 2 log 4
- 9 + 2 log 4
- 10 + 2 log 2
- 11 + 2 log 2
DOWNLOAD CONTOH SOAL & PEMBAHASAN ASAM BASA & TITRASI SBMPTN DALAM BENTUK PDF KLIK DISINI
- 6 - log 2
- 6 + log 2
- 8 - log 2
- 8 + log 2
- 10 + 2 log 2
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 25 ml = 0,5 mmol

Karena yang bersisa adalah basa lemah dan asam konjugasinya maka akan membentuk larutan penyangga basa, yang pH nya
pOH = 4 - log 4
pH = 10 + log 4 = 10 + 2 log 2
Jawaban E
- 2
- 3
- 4
- 5
- 6
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 55 ml = 1,1 mmol
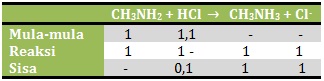
Karena yang bersisa adalah asam kuat maka pH dihitung dengan rumus asam kuat
![]()
[H+] = a. Ma = 1. 0,00125 M = 0,00125 M
Kemudian larutan diencerkan sampai 100 ml
M1. V1 = M2. V2
0,00125M. 80 ml = M2. 100 ml
![]()
maka pH = 3
Jawaban B
Fenol, C6H5OH merupakan asam lemah dengan Ka = 10-10. Sebanyak 30 ml larutan fenol 0,1 M dititrasi dengan larutan NaOH 0,1 M, nilai pH dalam labu titrasi dimonitor dengan pH meter. Setelah penambahan 15 mL NaOH, campuran larutan dalam labu titrasi diencerkan dengan H2O murni hingga volume 100 mL
- 1
- 2,5
- 4
- 5,5
- 10,0
PEMBAHASAN :
fenol C6H5OH merupakan asam lemah, maka pH nya dihitung menggunakan rumus asam lemah
![]()
pH = 5,5
Jawaban D
- 0,001
- 0,025
- 0,040
- 0,050
- 0,10
PEMBAHASAN :
n C6H5OH = M x V = 0,1 M x 30 ml = 3 mmol
n NaOH = M x V = 0,1 M x 10 ml = 1 mmol
Jika dituliskan dalam reaksi:
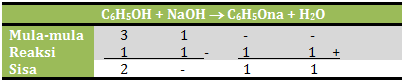
Maka konsentrasi natrium fenolat adalah
Jawaban B
- Na
- Ca
- Mg
- Zn
- Ag
PEMBAHASAN :
Pertama kali logam akan bereaksi dengan HCl. Golongan IA dan IIA dan juga Zn akan larut sedangkan logam Ag jika direaksikan dengan HCl akan membentuk AgCl yang akan pertama kali mengendap namun ketika direaksikan dengan KOH maka kelarutan yang paling rendah dialami oleh Zn(OH)2
Jawaban E
- CH3OH dan CH3O-
- HC2H3O2 dan HCO3-
- C6H5NH2 dan C6H5NH3-
- C2H3O2- dan HC2H3O2
- HCO3- dan CO32-
PEMBAHASAN :
Asam Basa menurut Bronsted-Lowry
Asam : Pemberi/donor proton (H+) → berkurang di akhir 1 H+
Basa : Penerima/akseptor proton (H+) → bertambah di akhir 1 H+
Perubahan dari asam menjadi basa konjugasi yaitu akan mengalami pengurangan sebanyak 1 H+
- CH3OH dan CH3O- : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HC2H3O2 dan HCO3- : : Bukan merupakan pasangan asam-basa konjugasi karena jumlah H nya tidak memiliki selisih 1 H+ dan jumlah atom lainnya berbeda
- C6H5NH2 dan C6H5NH3+ : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- C2H3O2- dan HC2H3O2 : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HCO3- dan CO32- : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
Jawaban yang tepat adalah B
Jawaban B
- CO32- bertindak sebagai asam Bronsted-Lowry
- SO42- bertindak sebagai asam Lewis
- CO2 bertindak sebagai asam Bronsted-Lowry
- CO2 bertindak sebagai basa Lewis
- SO3 bertindak sebagai asam lewis
PEMBAHASAN :
Pada reaksi:
CO32- + SO3 ![]() SO42- + CO2
SO42- + CO2
Tidak terdapat atom H yang bisa di serah terima kan pada teori Bronsted-Lowry
maka reaksi ini dijelaskan melalui teori Asam Basa Lewis
Basa Lewis merupakan donor/pemberi pasangan elektron, cirinya memiliki PEB atau bermuatan negatif. Pada reaksi tersebut yang berperan memberikan pasangan elektron adalah CO32- karena memiliki kelebihan elektron untuk diberikan, sedangkan yang berperan sebagai asam lewis atau penerima pasangan elektron adalah SO3
Jawaban E
- 0,08 M
- 0,40 M
- 0,80 M
- 1,60 M
- 3,20 M
PEMBAHASAN :
Untuk menentukan konsentrasi asam oksalat awal kita menentukan terlebih dahulu konsentrasi asam oksalat yang digunakan untuk menitrasi NaOH. Rumusan untuk titrasi dapat menggunakan
Diketahui:
a (valensi asam/jumlah atom H dalam asam oksalat) = 2
Va (volume asam oksalat yang digunakan untuk titrasi) = 25 mL
b (valensi basa/ jumlah OH dalam NaOH) = 1
Mb = Molaritas basa/NaOH = 0,2 M
Vb (volume NaOH yang digunakan untuk titrasi) = 20 mL
a. Ma. Va = b. Mb. Vb
2. Ma. 25 = 1. 0,2. 20
Ma = 4/50 = 0,08 M
Kemudian kita menentukan molaritas awal menggunakan rumusan pengenceran dengan volume akhir 100 mL yang diambil 25 mL untuk titrasi
M1.V1 = M2.V2
M1 . 10 mL = 0,08 M. 100 mL
M1 = 8/10 = 0,8 M
maka molaritas mula-mulanya adalah 0,8 M
Jawaban D
- 8
- 9
- 10
- 11
- 12
PEMBAHASAN :
Reaksi yang terjadi
3H2 + N2 ![]() 2NH3
2NH3
menentukan [H2] dan [N2]
Menentukan [NH3] dari data Kc pada suhu 300 oC
![]()
![]()
[NH3]2 = 10-5. 103 = 10-2
[NH3] = 10-1
Karena dilarutkan ke dalam air sehingga membentuk NH4OH yang merupakan basa lemah, maka pH nya
pOH = 3
pH = 14 - 3 = 11
Jawaban D
DOWNLOAD CONTOH SOAL & PEMBAHASAN ASAM BASA & TITRASI SBMPTN DALAM BENTUK PDF KLIK DISINI
 tanya-tanya.com Jika bisa gratis kenapa harus bayar
tanya-tanya.com Jika bisa gratis kenapa harus bayar 
