Contoh Soal & Pembahasan Sifat Koligatif SBMPTN Kimia SMA
- Titik beku air menurun ketika ditambahkan garamnya
- Lobster akan mati jika disimpan dalam air tawar
- Zat anti beku ditambahkan ke dalam radiator untuk menjaga mesin mobil agar tetap dingin
- Pada daerah pegunungan, waktu untuk memasak spageti menjadi lebih lama
PEMBAHASAN :
- Titik beku air menurun ketika ditambahkan garamnya sesuai prinsip penurunan titik beku dimana jika pelarut ditambahkan zat terlarut maka titik beku akan mengalami penurunan
- Lobster laut akan mati jika disimpan dalam air tawar. Ini merupakan pengaruh tekanan osmosis yang berbeda antara air laut dan air tawar. Hal ini merupakan fenomena sifat koligatif tekanan osmosis
- Zat anti beku ditambahkan ke dalam radiator untuk mejaga mesin mobil agar tetap dingin sesuai dengan prinsip penurunan titik beku
- Pada daerah pegunungan waktu untuk memasak spageti menjadi lebih lama seharusnya memasak di pegunungan memasak air akan lebih cepat karena daerah pegunungan tekanan udaranya lebih rendah
Jawaban D
- 100
- 250
- 400
- 700
- 1400
PEMBAHASAN :
Jika ada dua larutan yang diketahui maka kita bisa membandingkannya untuk menentukan Mr zat organik
![]()
Karena ΔTb B = 2. ΔTb A, dan nilai Kb akan sama karena pelarutnya sama. Nilai i untuk larutan BaCl2 adalah 3 sesuai dengan jumlah ionnya.
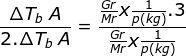

![]()
![]()
Jawaban B
- 49,2
- 80,0
- 120,0
- 147,6
- 221,4
PEMBAHASAN :
Diketahui:
Gr = 8 gram
Elektrolit kuat L2X, maka jumlah ionnya (n) = 3
π = 4 atm
T = 27 oC = 300 K
R = 0,082
V = 1 L air (penambahan volume zat terlarut diabaikan)
Menentukan Mr dari tekanan osmosis
π = M. R.T .i
![]()
![]()
Jawaban D
- 2 : 3
- 1 : 2
- 1 : 1
- 3 : 2
- 2 : 1
PEMBAHASAN :
Diketahui:
mol urea = 0,01 mol
P air yang dilarutkan urea = 500 gr = 0,5 kg
mol NaBr = 0,001 mol
mol Na2SO4 = 0,001 mol
P air yang dilarutkan NaBr + Na2SO4 = 500 gr = 0,5 kg
terdisosiasi sempurna artinya elektrolit kuat, maka
jumlah ion NaBr (n) = 2
jumlah ion Na2SO4 (n) = 3
Menetukan perbandingan penurunan titik beku kedua larutan
![]()
Kf di coret karena nilainya sama untuk pelarut yang sama
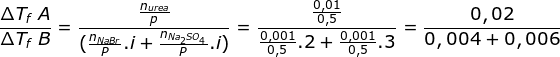
![]()
Jawaban E
- 6/5
- 2/3
- 1/2
- 2/5
- 1/3
PEMBAHASAN :
Diketahui:
Gr NaCl = 58,5 g
Mr NaCl = 58,5
P air yang dilarutkan NaCl = 5 kg
Gr MgCl2 = 190 g
Mr MgCl2 = 95
P air yang dilarutkan MgCl2 = 5 kg
terionisasi sempurna artinya elektrolit kuat, maka
jumlah ion NaCl (n) = 2
jumlah ion MgCl2 (n) = 3
Menetukan perbandingan kenaikan titik didih kedua larutan
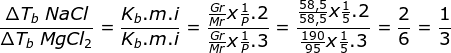
Jawaban E
- 1,5t oC
- 2t oC
- 2,5t oC
- 3t oC
- 3,5t oC
PEMBAHASAN :
Diketahui:
mol gula = 0,1 mol
mol LX2 = 0,1 mol
V air = 1 liter, maka P = ρ. V = 1 kg/L. 1 L = 1 kg
ΔTf gula = t oC
Menentukan ΔTf LX2 melalui perbandingan
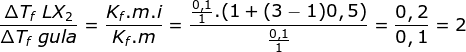
ΔTf LX2 = 2. ΔTf gula = 2t oC
Jawaban B
- 44
- 60
- 80
- 100
- 200
PEMBAHASAN :
Diketahui:
Gram Na2SO4 = 14,2 gr
Mr Na2SO4 = 142
V air = 500 ml, maka P = ρ. V = 1 gr/ml . 500 ml = 500 gr
TbL Na2SO4 = 100,3 oC
Gr zat organik non elektrolit = 20 g
TbL zat organik = 100,1 oC
Na2SO4 merupakan elektrolit kuat, maka i = n = 3
Menentukan Mr zat organik melalui perbandingan kenaikan titik didih
![]() (Kb dapat dicoret karena pelarutnya sama)
(Kb dapat dicoret karena pelarutnya sama)
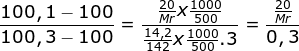
![]()
![]()
![]()
Jawaban E
- 3,72 oC
- 1,86 oC
- -1,86 oC
- -3,72 oC
- -5,58 oC
PEMBAHASAN :
Diketahui:
Gr etilen glikol = 620 gram
Mr = 62
P = 5 kg
Kf = 1,86 oC/m
Menentukan titik beku larutan
ΔTf = Kf. m
![]()
ΔTf = Tfo – TfL
3,72 = 0 – TfL
TfL = – 3,72 oC
Jawaban D
- Mempunyai titik beku yang sama dengan larutan 9 gram urea (Mr = 60) dalam 500 g air
- Konsentrasi semua partikel terlarut adalah 0,6 molal
- Nilai faktor van’t Hoff untuk larutan tersebut adalah 3
- Larutan membeku pada -0,186 oC
PEMBAHASAN :
Menentukan titik beku Na2SO4 (elektrolit kuat dengan i = n = 3)
ΔTf = Kf. m. i
ΔTf = 1,86. 0,1. 3 = 0,558
ΔTf = Tfo – TfL
0,558 = 0 – TfL
TfL = – 0,558 oC
- Menentukan titik beku urea
ΔTf = Kf. m

ΔTf = 1,86. 0,1. 3 = 0,558
ΔTf = Tfo – TfL
0,558 = 0 – TfL
TfL = – 0,558 oC
BENAR - Karena elektrolit kuat, maka jumlah partikel totalnya = 3, maka konsentrasi semua partikelnya = m. i = 0,1 x 3 = 0,3 m
SALAH - Nilai faktor Van’t Hoff (i) = jumlah ion (n) = 3
BENAR - Titik beku larutannya adalah -0,558 oC
SALAH
Maka jawaban yang benar adalah 1 dan 3
Jawaban B
- -0,93 oC
- -1,86 oC
- -3,72 oC
- -5,58 oC
- -7,64 oC
PEMBAHASAN :
Diketahui:
Gr etilen glikol = 62 gram
Mr = 62
P = 500 gram
Kf = 1,86 oC/m
Menentukan titik beku larutan
ΔTf = Kf. m
![]()
ΔTf = Tfo – TfL
3,72 = 0 – TfL
TfL = – 3,72 oC
Jawaban C