Contoh Soal & Pembahasan Elektrolisis & Hukum Faraday SBMPTN Kimia SMA
Elektrolisis 100 mL larutan CuSO4 0,1 M dalam bejana A dan 100 mL larutan AgNO3 dalam bejana B dilakukan seri menggunakan arus tetap 1 A pada anoda dan katoda Pt. Pada tiap-tiap katoda terbentuk endapan Cu dan Ag sementara pada anoda dihasilkan gas O2 (Ar Cu = 63,5; Ar Ag = 108 dan konstanta Farady = 96500 C/mol). Setelah elektrolisis berlangsung 60 detik….
- massa Cu yang mengendap lebih besar daripada massa Ag
- jumlah atom Cu yang mengendap sama dengan jumlah atom Ag
- volume gas O2 yang dihasilkan pada bejana A lebih besar daripada volume gas O2 yang dihasilkan pada bejana B
- pH larutan dalam bejana A sama dengan pH larutan dalam bejana B
PEMBAHASAN :
Menentukan mol elektron
![]()
Reaksi elektrolisis CuSO4
CuSO4 → Cu2+ + SO42-
K(-) : 2Cu2+ + 4e– → 2Cu(s)
A(+) : 2H2O → 4H+ + 4e– + O2(g)
Reaksi elektrolisis AgNO3
AgNO3 → Ag+ + NO3–
K(-) : 4Ag+ + 4e– → 4Ag(s)
A(+) : 2H2O → 4H+ + 4e– + O2(g)
Maka mol Ag dan mol Cu dapat ditentukan dari perbandingan koefisien
mol Ag = 4/4 x 6,21 x 10-4 = 6,21 x 10-4 mol
mol Cu = 2/4 x 6,21 x 10-4 = 3,1 x 10-4 mol
- menentukan massa Ag dan Cu
massa Ag = n x Ar = 6,21 x 10-4 x 108 = 6,71 x 10-2 gram
massa Cu = n x Ar = 3,1 x 10-4 x 63,5 = 1,97 x 10-2 gram
Maka massa Ag yang lebih besar
SALAH - menentukan jumlah atom Ag dan Cu
jumlah atom Ag = n x Ar = 6,21 x 10-4 x 6,02 x 1023 = 37,38 x 10-19 atom
jumlah atom Cu = n x Ar = 3,1 x 10-4 x 6,02 x 1023 = 18,66 x 10-19 atom
Maka jumlah atom Ag yang lebih banyak
SALAH - menentukan volume O2 di bejana A dan bejana B
jumlah volume O2 di kedua bejana akan sama karena jumlah mol O2 akan sama hasil perbandingan dengan mol elektron
SALAH - menentukan pH di kedua bejana
pH di kedua bejana akan sama karena jumlah mol H+ akan sama hasil perbandingan dengan mol elektron
BENAR
Jawaban D
Suatu baterai dengan elektroda Al3+|Al dan Ni2+|Ni pada keadaan standar menghasilkan arus 0,2 A selama 804 menit. Nilai Eo Al3+|Al = -1,66 V, Eo Ni2+|Ni = -0,25 V, F = 96500 C/mol elektron, Ar Al = 27, dan Ar Ni = 59. Pengurangan massa di anoda adalah…
- 5,9 g
- 2,9 g
- 2,7 g
- 1,5 g
- 0,9 g
PEMBAHASAN :
Yang bertindak sebagai anoda adalah Al karena Nilai Eo nya lebih kecil dibanding Ni. Pada anode terjadi reaksi oksidasi sebagai berikut:
Al → Al3+ + 3e–
Menentukan mol elektron terlebih dahulu
![]()
Maka mol Al yang berkurang dapat diperoleh dengan perbandingan koefisien
![]()
![]()
Maka massa Al yang berkurang adalah
Massa Al = n x Ar Al = 1/30 x 27 = 0,9 gram
Jawaban E
2H2(g) + O2(g) → 2H2O(g)
Untuk menghasilkan arus tetap sebesar 0,193 A (F = 96500 C/mol e–), sel bahan bakar tersebut menghabiskan H2 dengan laju…
- 1 x 10-6 g/s
- 2 x 10-6 g/s
- 3 x 10-6 g/s
- 4 x 10-6 g/s
- 5 x 10-6 g/s
PEMBAHASAN :
Menentukan jumlah elektron yang terlibat
2H2(g) + O2(g) → 2H2O(g)
H mengalami perubahan biloks dari 0 ke +1 (agar sama di x 2)
O mengalami perubahan biloks dari 0 ke -2
Maka elektron yang terlibat adalah 2 mol
Waktu yang dibutuhkan adalah 1 detik Sesuai pilihan jawaban per 1 sekon. Menentukan terlebih dahulu mol elektron
![]()
Menentukan mol H2 dari perbandingan koefisien dengan mol e
H2 → 2H+ + 2e–
![]()
Maka laju H2 nya dapat ditentukan dari massa nya
massa H2 = n x Ar H2 = 10-6 x 2 = 2 x 10-6 gram
Maka lajunya adalah 2 x 10-6 gram/detik
Jawaban B
- 39,4 gram
- 59,1 gram
- 78,8 gram
- 118,2 gram
- 177,3 gram
PEMBAHASAN :
Jika menggunakan arus/muatan listrik yang sama, maka berlaku hukum Faraday II
mol e1 = mol e2
Menentukan mol elektron yang dihasilkan dari elektrolisis larutan NaCl
NaCl → Na+ + Cl–
K(-) : 2H2O + 2e– → 2OH– + H2
A(+) : 2Cl– → Cl2 + 2e–
mol Cl2 yang dihasilkan pada kondisi STP
![]()
Maka mol e nya diperoleh dari perbandingan koefisien
![]()
Menentukan massa Au yang dihasilkan
![]()
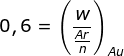
![]()
Jawaban A
- 0,05 mol
- 0,10 mol
- 1,20 mol
- 1,00 mol
- 2,00 mol
PEMBAHASAN :
Reaksi elektrolisis CuSO4
K(-) : 2Cu2+ + 4e– → 2Cu
A(+) : 2H2O → 4H+ + 4e + O2
Menentukan mol Cu
![]()
Maka mol elektron diperoleh melalui perbandingan koefisien
![]()
Jawaban B
- 2,24 L
- 3,36 L
- 4,48 L
- 5,60 L
- 6,72 L
PEMBAHASAN :
Jika menggunakan arus/muatan listrik yang sama, maka berlaku hukum Faraday II
mol e1 = mol e2
Menentukan mol elektron yang dihasilkan dari reduksi Al
Al3+ + 3e– → Al
Menentukan mol Al
![]()
Maka mol e nya diperoleh dari perbandingan koefisien
![]()
Reaksi reduksi larutan asam
2H+ + 2e– → H2
Menentukan mol H2 dari mol elektron
![]()
Maka volume H2 yang dihasilkan pada kondisi STP adalah
V = n x 22,4 = 0,15 x 22,4 L = 3,36 L
Jawaban B
PEMBAHASAN :
Reaksi elektrolisis leburan KCl
KCl → K+ + Cl–
K+ ke katoda, Cl– ke anoda
K(+) : K+ + e– → K (yang bereaksi K karena leburan tidak ada air)
A(-) : 2Cl– → Cl2 + 2e–
Pernyataan Benar dan Alasan Benar saling berhubungan, maka jawabannya adalah A
Jawaban A
- AgNO3
- CuCl2
- ZnCl2
- CuSO4
- K2SO4
PEMBAHASAN :
- AgNO3
AgNO3 → Ag+ + NO3–
K(-) : Ag+ + e- → Ag(s)
A(+) : 2H2O → 4H+ + 4e– + O2(g)
Hanya di anoda yang menghasilkan gas - CuCl2
CuCl2 → Cu2+ + 2Cl–
K(-) : Cu2+ + 2e– → Cu(s)
A(+) : 2Cl– → Cl2(g) + 2e–
Hanya di anoda yang menghasilkan gas - ZnCl2
ZnCl2 → Zn2+ + 2Cl–
K(-) : Zn2+ + 2e– → Zn(s)
A(+) : 2Cl– → Cl2(g) + 2e–
Hanya di anoda yang menghasilkan gas - CuSO4
CuSO4 → Cu2+ + SO42-
K(-) : Cu2+ + 2e– → Cu(s)
A(+) : 2H2O → 4H+ + 4e– + O2(g)
Hanya di anoda yang menghasilkan gas - K2SO4
K2SO4 (aq) → 2K+ + SO42-
K(-) : 2H2O + 2e– → 2OH– + H2(g)
A(+) : 2H2O → 4H+ + 4e– + O2(g)
Di katoda dan anoda menghasilkan gas
Jawaban E
- 0,5 Faraday
- 0,75 Faraday
- 1,5 Faraday
- 3 Faraday
- 3,5 Faraday
PEMBAHASAN :
Reaksi reduksi Ag
Ag+ + e– → Ag
diketahui mol e– = F = 1,5 F, maka mol Ag+ = 1,5 mol lewat perbandingan koefisien
Maka jika Ag di ganti Cu maka reaksi reduksi Cu (mol Cu2+ = 1,5 sama dengan mol Ag+)
Cu2+ + 2e– → Cu
1,5 mol
Maka mol e diperoleh lewat perbandingan koefisien = 2/1 x 1,5 mol = 3 mol e = 3 faraday
Jawaban D