Contoh Soal & Pembahasan PAS/UAS Ganjil Kimia Kelas XI Part I
- C3H6 dan C4H10
- C3H8 dan C5H12
- C4H8 dan C6H10
- C5H8 dan C6H14
- C5H10 dan C6H14
PEMBAHASAN :
Hidrokarbon tak jenuh merupakan hidrokarbon yang jumlah H nya lebih sedikit. yaitu alkena dan alkuna. Sedangkan hidrokarbon jenuh merupakan hidrokarbon yang lebih banyak atom hidrogennya yaitu alkana. Alkena memiliki rumus CnH2n sedangkan alkuna memiliki rumus umum cnH2n-2. Maka yang termasuk hidrokarbon tak jenuh adalah C4H8 (alkena) dan C6H10 (alkuna)
Jawaban C
- CH3 ‒ CH2 ‒ CHBr – CH2 – CH3
- CH3 ‒ CHBr ‒ CH2 ‒ CH2 ‒ CH3
- CH3 ‒ CH = CBr ‒ CH2 ‒ CH3 + H2
- CH3 ‒ CH2 ‒ CH2 – CH2 ‒ CH2 ‒ Br
- CH3 ‒ C = C ‒ CH2 ‒ CH3
PEMBAHASAN :
Reaksi yang terjadi antara 2 – pentena dengan HBr dapat dituliskan melalui persamaan reaksi berikut:
CH3 – CH = CH – CH2 – CH3 + HBr → CH3 – CH2 – CHBr – CH2 – CH3
1 2 3 4 5
Atom H dan Br dari HBr akan masuk ke atom C yang berada di antara ikatan rangkap 2 yaitu atom C no 2 dan 3. Atom H akan masuk ke atom C no 2 sedangkan atom Br akan masuk ke atom No 3. Sesuai dengan aturan Markovnikoff. Atom H akan masuk ke atom C yang memiliki H lebih banyak. Karena atom C no 2 dan 3 memiliki atom yang sama banyak. Maka banyak sedikitnya atom H yang diikat dapat dilihat dari atom H yang diikat oleh atom C yang menempel langsung pada C no 2 dan 3. Atom C no 1 mengikat atom H lebih banyak dibanding atom C no 3. sehingga atom H dari HBr akan mengikat ke atom C no 2 dan atom Br mengikat pada atom C no.3.
Jawaban A
- Obat – obatan
- Serat sintesis
- Bahan kosmetik
- Pengawet makanan
- Bahan bakar
PEMBAHASAN :
Senyawa hidrokarbon banyak dimanfaatkan untuk bahan bakar yang merupakan komponen terbanyak dalam minyak bumi. Minyak bumi kemudian di destilasi yang menghasilkan fraksi-fraksi minyak bumi diantaranya: LPG, Bensol, Bensin, minyak tanah, solar yang digunakan untuk bahan bakar.
Jawaban E
- C (s) + 2Cl2 (g) → CCl4 (l) ∆H = -134 kJ
- Ca (s) + Cl2 (g) → CaCl2 (s) ∆H = -795,8 kJ
- Fe2 (s) + O2 (g) → Fe2O3 (s) ∆H = -822,2 kJ
- Na (s) + H2 (g) + C (s) + O2 (g) → NaHCO3 (s) ∆H = -795,8 kJ
- Zn (s) + O2 (g) → ZnO (s) ∆H = -348 kJr
PEMBAHASAN :
Perubahan entalpi pembentukan standar (∆Hoƒ), merupakan pembentukan 1 mol (koefisien = 1) senyawa yang diebntuk dari unsur-unsurnya yang paling stabil. Yang bukan merupakan ∆Hoƒ adalah pilihan C. Fe2O3 dibentuk dari unsur Fe yang dalam keadaan stabilnya berbentuk monoatomik (Fe) bukan diatomik (Fe2).
Jawaban C
Untuk dapat menguraikan 5,6 L (Pada STP) gas SO3 menjadi SO2 dan O2, diperlukan kalor sebanyak?
- -198 kJ
- -99 kJ
- -24,75 kJ
- +24,75 kJ
- +99 kJ
PEMBAHASAN :
Diketahui reaksi:
2SO2 (g) + O2 (g) → 2SO3 (g) ∆H = -198 kJ
Di soal ditanyakan untuk reaksi penguraian SO3, maka reaksi tersebut akan dibalik sehingga ∆H akan bernilai positif (+). Sedangkan di soal diketahui ∆H untuk 2 mol SO3 dilihat dari koefisiennya = 2. Sedangkan yang ditanyakan adalah untuk 5,6 L (STP), atau kalau diubah ke mol menjadi:
![]()
Maka untuk 0,25 mol penguraian SO3 besar ∆H nya adalah
![]()
Jawaban D
x merupakan kalor?
- Pembentukan NO2
- Pembakaran NO
- Pembakaran NO2
- Peruraian NO2
- Pembentukan NO
PEMBAHASAN :
Reaksi di atas merupakan reaksi pembakaran NO. Reaksi pembakaran merupakan reaksi 1 mol suatu zat dengan oksigen. Reaksi penguraian atau pembentukan harus dibentuk atau diuraikan oleh unsur-unsurnya yang paling stabil. Jadi jawaban yang paling tepat adalah B
Jawaban B
2Ca (s) + O2 (g) → 2CaO (s) ∆H = -1.269 kJ
CaO (s) + H2O (l) → Ca(OH)2 (s) ∆H = -64 kJ
Entalpi pembentukan Ca(OH)2 (s) adalah?
- -1.966 kJ mol-1
- -1.904 kJ mol-1
- -1.161 kJ mol-1
- -984 kJ mol-1
- -64 kJ mol-1
PEMBAHASAN :
Reaksi pembentukan Ca(OH)2 adalah sebagai berikut:
Ca(s) + O2(g) + H2(g) → Ca(OH)2 (s)
Jika cara pengerjaannya menggunakan Hukum Hess Maka terjadi perubahan dari reaksi yang diketahui ∆H nya agar posisi dan koefisien yang diketahui ∆H nya sama dengan reaksi yang ditanyakan ∆H nya.
2H2 (g) + O2 (g) → 2H2O (l) ∆H = -571 kJ (dibagi 2)
2Ca (s) + O2 (g) → 2CaO (s) ∆H = -1.269 kJ (dibagi 2)
CaO (s) + H2O (l) → Ca(OH)2 (s) ∆H = -64 kJ (tetap)
Sehingga perubahannya menjadi:
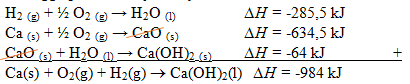
Jawaban D
Laju reaksi dinyatakan sebagai?
- Laju berkurangnya konsentrasi Fe3O4 tiap satu satuan waktu
- Laju berkurangnya konsentrasi H2 tiap satu satuan waktu
- Laju bertambahnya konsentrasi Fe tiap satu satuan waktu
- Laju berkurangnya tekanan sistem tiap satu satuan waktu
- Laju bertambahnya konsentrasi H2 tiap satu satuan waktu
PEMBAHASAN :
Laju reaksi dijelaskan dengan berkurangnya konsentrasi pereaksi per satuan waktu atau bertambahnya konsentrasi produk per satuan waktu. Fe dan H2O akan mengalami pengurangan konsentrasi karena sebagai pereaksi. Sedangkan Fe3O4 dan H2 akan mengalami pertambahan konsentrasi. Sehingga jawaban yang tepat adalah E
Jawaban E
Jika dalam 10 detik pertama terbentuk 0,1 mol oksigen, laju peruraian H2O2 adalah?
- 0,002 M s-1
- 0,008 M s-1
- 0,001 M s-1
- 0,0140 M s-1
- 0,004 M s-1
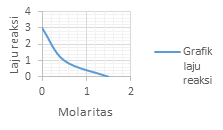
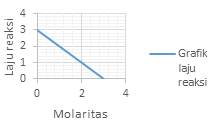
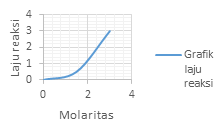
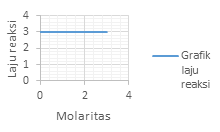
Grafik laju reaksi (r) terhadap konsentrasi (M) yang menunjukan reaksi Orde 1 adalah?
PEMBAHASAN :
Orde 1 atau v = k[A]. akan memperlihatkan grafik yang linear
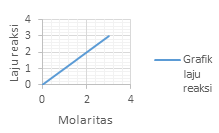
Dimana kenaikan konsentrasi akan diikuti dengan kenaikan laju dengan besar yang sama dengan kenaikan konsentrasinya
Jawaban D