Contoh Soal Penyetaraan Reaksi Redoks Pembahasan & Jawabannya Kelas 12
Soal No.1
Setarakan Reaksi berikut dengan metode biloks
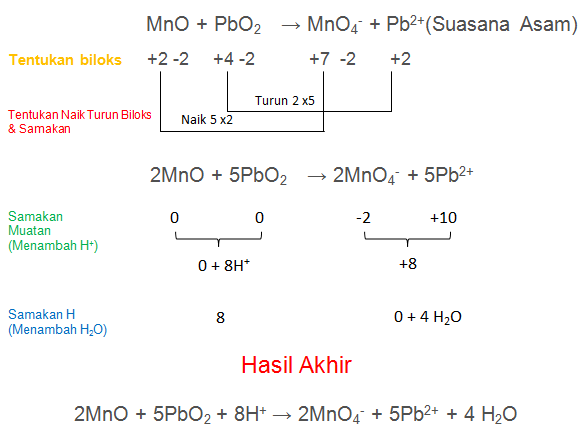
MnO + PbO2 → MnO4− + Pb2+(Suasana Asam)
MnO + PbO2 → MnO4− + Pb2+(Suasana Asam)
PEMBAHASAN :
No.2
Setarakan Reaksi berikut dengan metode biloks
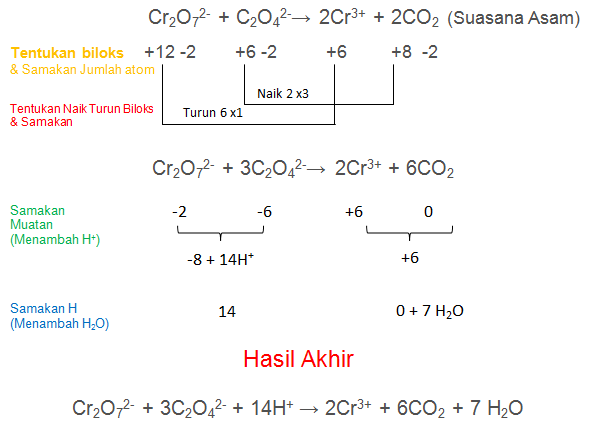
Cr2O72- + C2O42-→ Cr3+ + CO2(Suasana Asam)
Cr2O72- + C2O42-→ Cr3+ + CO2(Suasana Asam)
PEMBAHASAN :
Soal No.3
Setarakan Reaksi berikut dengan metode biloks
Zn + NO3–→ Zn2+ + NH4+(Suasana Asam)
Zn + NO3–→ Zn2+ + NH4+(Suasana Asam)
PEMBAHASAN :

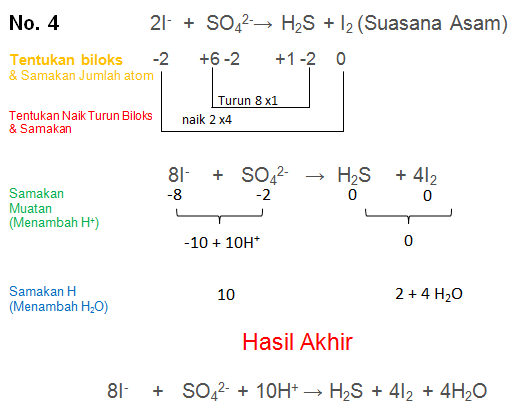
Soal No.4
Setarakan Reaksi berikut dengan metode biloks
I− + SO42-→ H2S + I2 (Suasana Asam)
I− + SO42-→ H2S + I2 (Suasana Asam)
Soal No.5
Setarakan Reaksi berikut dengan metode biloks
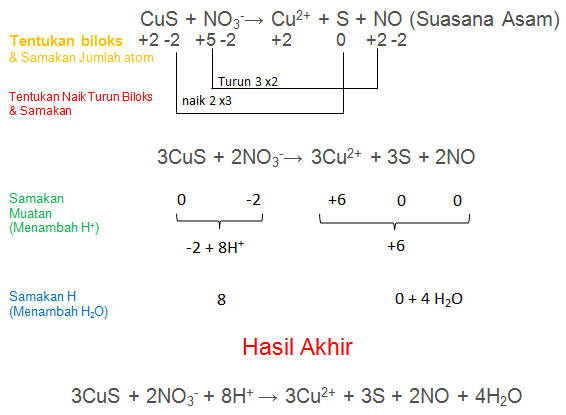
CuS + NO3−→ Cu2+ + S + NO (Suasana Asam)
CuS + NO3−→ Cu2+ + S + NO (Suasana Asam)
PEMBAHASAN :
Soal No.6
Setarakan Reaksi berikut dengan metode biloks
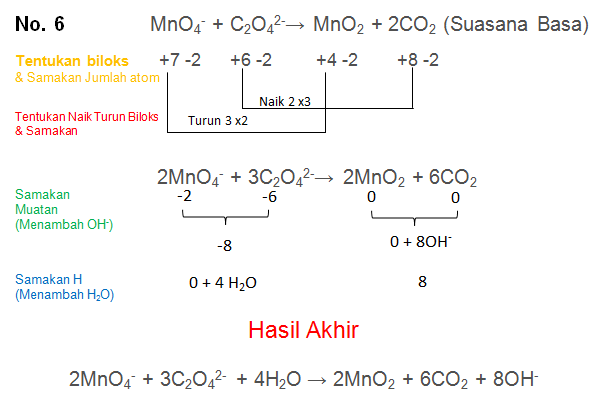
MnO4− + C2O42-→ MnO2 + CO2 (Suasana Basa)
MnO4− + C2O42-→ MnO2 + CO2 (Suasana Basa)
PEMBAHASAN :
Soal No.7
Setarakan Reaksi berikut dengan metode biloks
CrO42- + Fe(OH)2→ Cr2O3 + Fe(OH)3 (Suasana Basa)
CrO42- + Fe(OH)2→ Cr2O3 + Fe(OH)3 (Suasana Basa)
PEMBAHASAN :

Soal No.8
Setarakan Reaksi berikut dengan metode biloks
Cl2 + IO3−→ Cl− + IO4− (Suasana Basa)
Cl2 + IO3−→ Cl− + IO4− (Suasana Basa)
PEMBAHASAN :

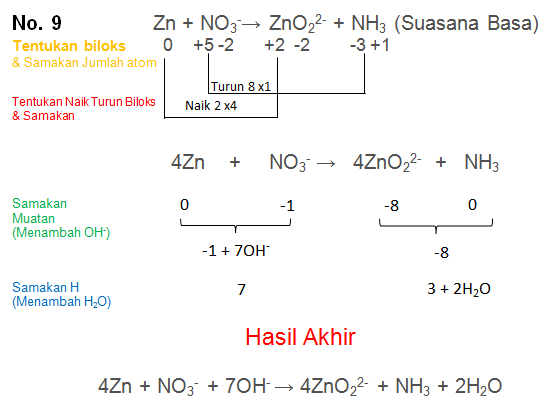
Soal No.9
Setarakan Reaksi berikut dengan metode biloks
Zn + NO3−→ ZnO22- + NH3 (Suasana Basa)
Zn + NO3−→ ZnO22- + NH3 (Suasana Basa)
PEMBAHASAN :
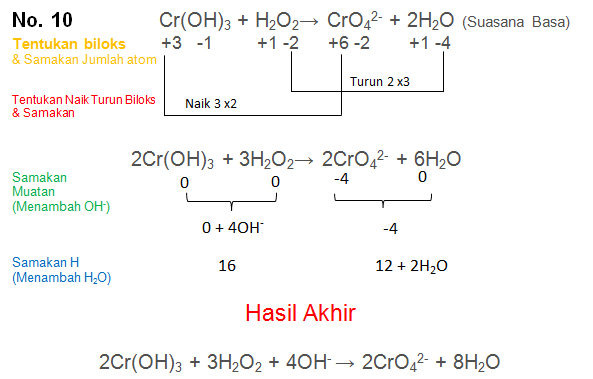
Soal No.10
Setarakan Reaksi berikut dengan metode biloks
Cr(OH)3 + H2O2→ CrO42- + H2O (Suasana Basa)
Cr(OH)3 + H2O2→ CrO42- + H2O (Suasana Basa)
PEMBAHASAN :
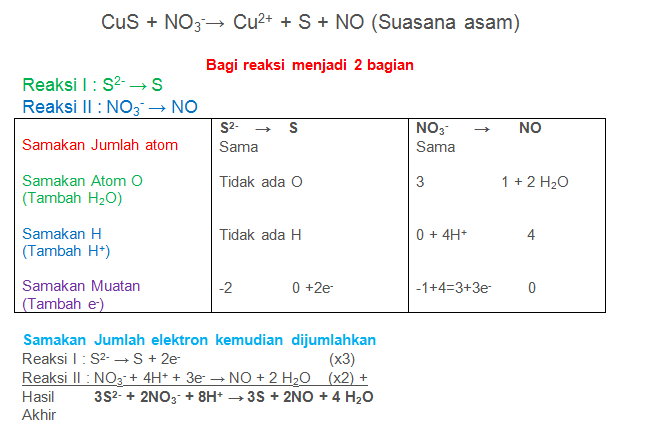
Soal No.11
Setarakan Reaksi berikut dengan metode setengah reaksi
CuS + NO3−→ Cu2+ + S + NO (Suasana asam)
CuS + NO3−→ Cu2+ + S + NO (Suasana asam)
PEMBAHASAN :
Soal No.12
Setarakan Reaksi berikut dengan metode setengah reaksi
MnO + PbO2→ MnO4− + Pb2+ (Suasana asam)
MnO + PbO2→ MnO4− + Pb2+ (Suasana asam)
PEMBAHASAN :

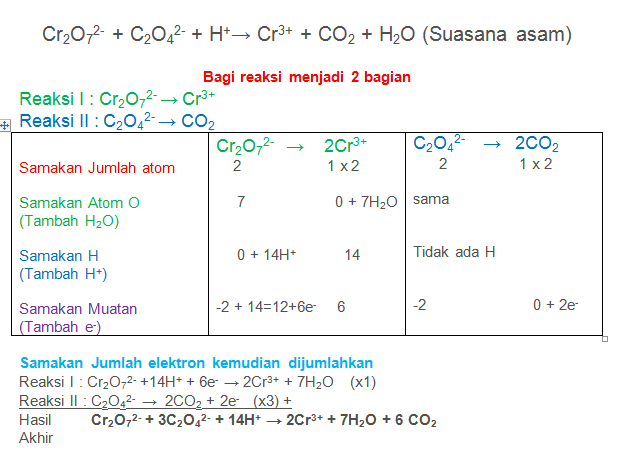
Soal No.13
Setarakan Reaksi berikut dengan metode setengah reaksi
Cr2O72- + C2O42-+ H+→ Cr3+ + CO2 + H2O (Suasana asam)
Cr2O72- + C2O42-+ H+→ Cr3+ + CO2 + H2O (Suasana asam)
PEMBAHASAN :
Soal No.14
Setarakan Reaksi berikut dengan metode setengah reaksi
MnO4− + H2S + H+→ Mn+2 + S + H2O (Suasana asam)
MnO4− + H2S + H+→ Mn+2 + S + H2O (Suasana asam)
PEMBAHASAN :

Soal No.15
Setarakan Reaksi berikut dengan metode setengah reaksi
Zn + NO3− → Zn2+ NH4+(Suasana asam)
Zn + NO3− → Zn2+ NH4+(Suasana asam)
PEMBAHASAN :

Soal No.16
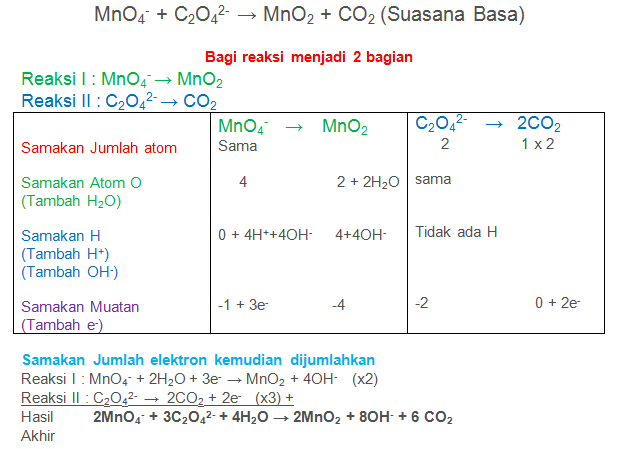
Setarakan Reaksi berikut dengan metode setengah reaksi
MnO4− + C2O42- → MnO2 + CO2 (Suasana Basa)
MnO4− + C2O42- → MnO2 + CO2 (Suasana Basa)
PEMBAHASAN :
Soal No.17
Setarakan Reaksi berikut dengan metode setengah reaksi
CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3 (Suasana Basa)
CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3 (Suasana Basa)
PEMBAHASAN :

Soal No.18
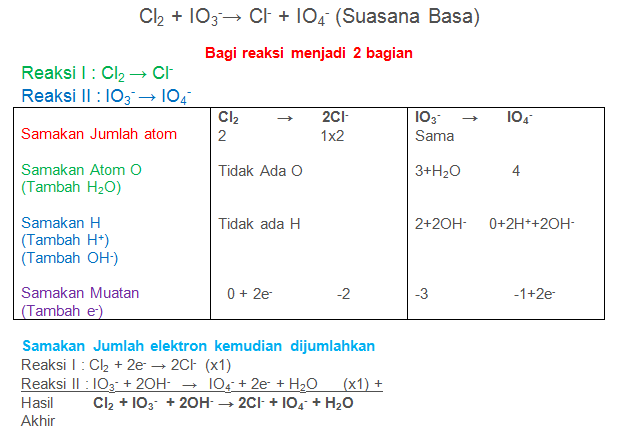
Setarakan Reaksi berikut dengan metode setengah reaksi
Cl2 + IO3−→ Cl− + IO4− (Suasana Basa)
Cl2 + IO3−→ Cl− + IO4− (Suasana Basa)
PEMBAHASAN :
Soal No.19
Setarakan Reaksi berikut dengan metode setengah reaksi
Cr(OH)3 + H2O2→ CrO42- + H2O (Suasana Basa)
Cr(OH)3 + H2O2→ CrO42- + H2O (Suasana Basa)
PEMBAHASAN :

Soal No.20
Setarakan Reaksi berikut dengan metode setengah reaksi
Zn + NO3−→ ZnO22- + NH3 (Suasana Basa)
Zn + NO3−→ ZnO22- + NH3 (Suasana Basa)
PEMBAHASAN :

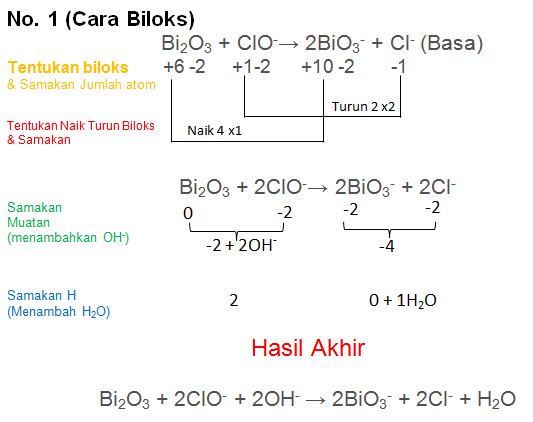
Soal No.21
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
Bi2O3 + ClO−→ BiO3− + Cl− (Basa)
Bi2O3 + ClO−→ BiO3− + Cl− (Basa)
Soal No.22
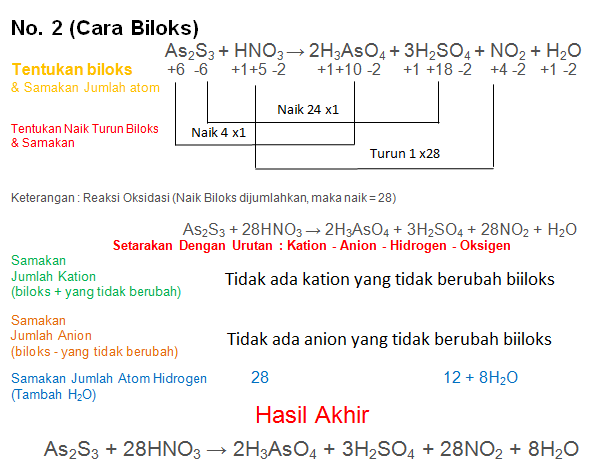
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
As2S3 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O
As2S3 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O
PEMBAHASAN :

Soal No.23
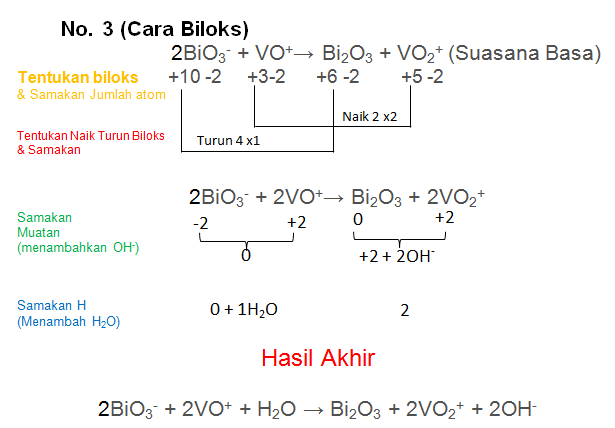
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
BiO3− + VO+→ Bi2O3 + VO2+ (Suasana Basa)
BiO3− + VO+→ Bi2O3 + VO2+ (Suasana Basa)
PEMBAHASAN :

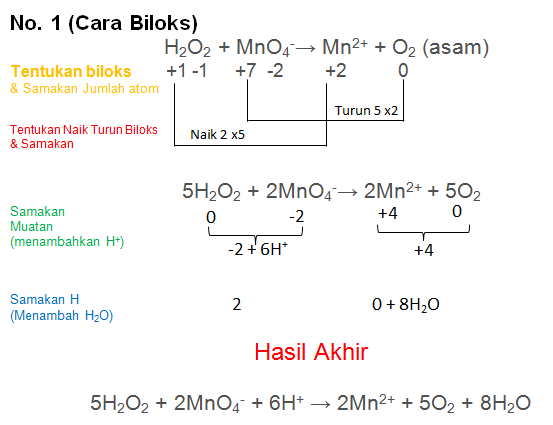
Soal No.24
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
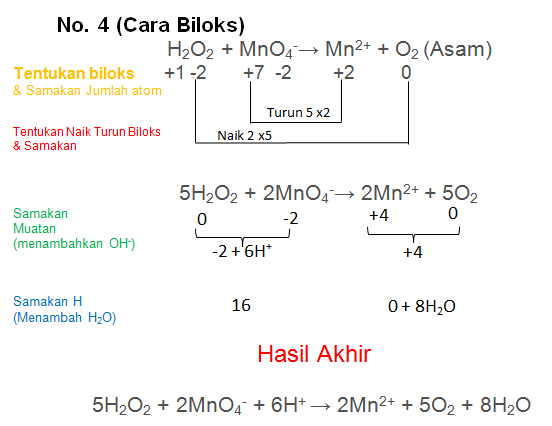
H2O2 + MnO4−→ Mn2+ + O2 (Asam)
H2O2 + MnO4−→ Mn2+ + O2 (Asam)
PEMBAHASAN :

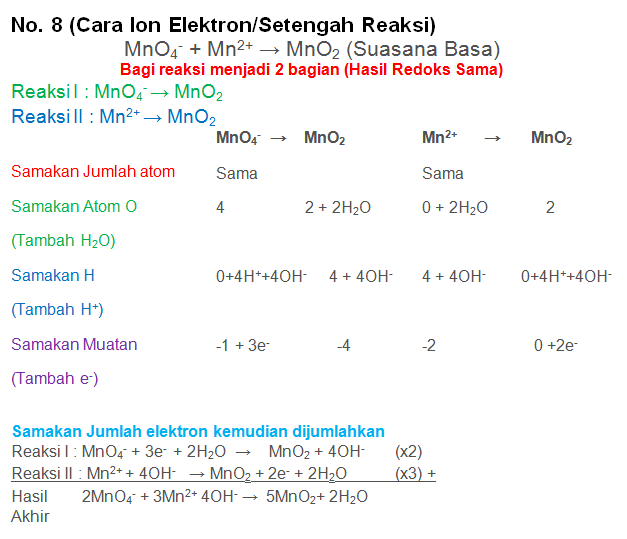
Soal No.25
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
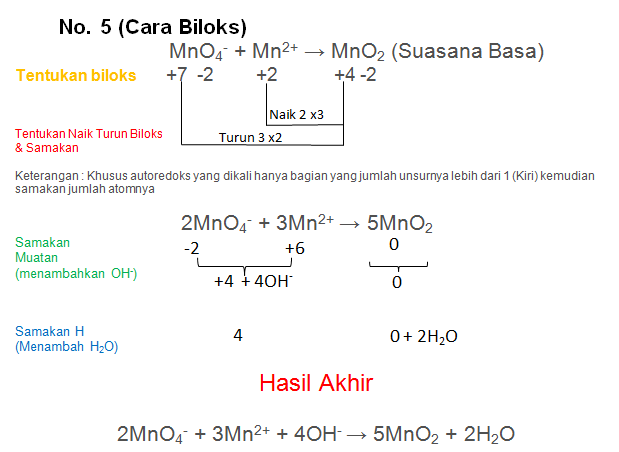
MnO4− + Mn2+ → MnO2 (Suasana Basa)
MnO4− + Mn2+ → MnO2 (Suasana Basa)
PEMBAHASAN :

Soal No.26
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
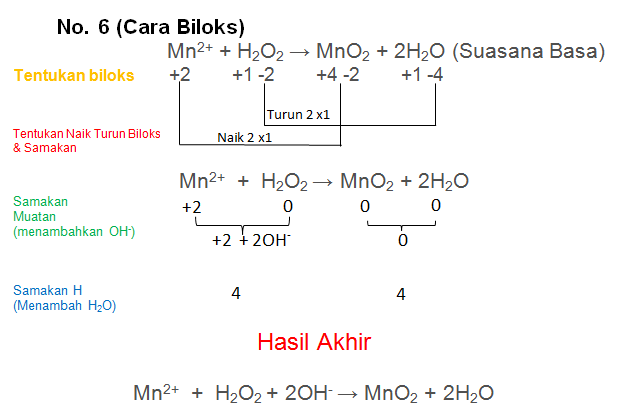
Mn2+ + H2O2 → MnO2 + H2O (Suasana Basa)
Mn2+ + H2O2 → MnO2 + H2O (Suasana Basa)
PEMBAHASAN :

Soal No.27
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
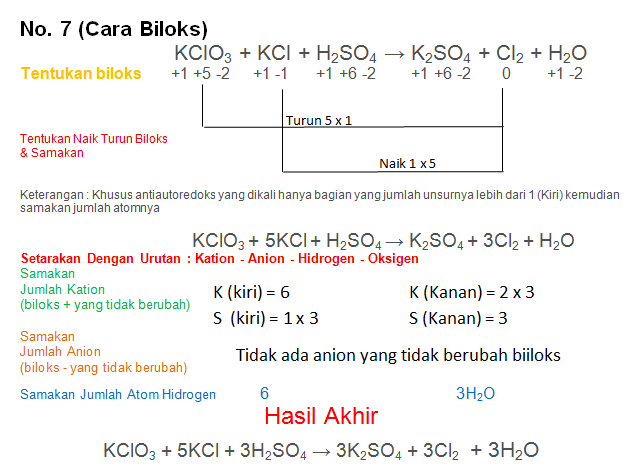
KClO3 + KCl + H2SO4 → K2SO4 + Cl2 + H2O
KClO3 + KCl + H2SO4 → K2SO4 + Cl2 + H2O
PEMBAHASAN :

Soal No.28
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
H2O2 + MnO4−→ Mn2+ + O2 (asam)
H2O2 + MnO4−→ Mn2+ + O2 (asam)
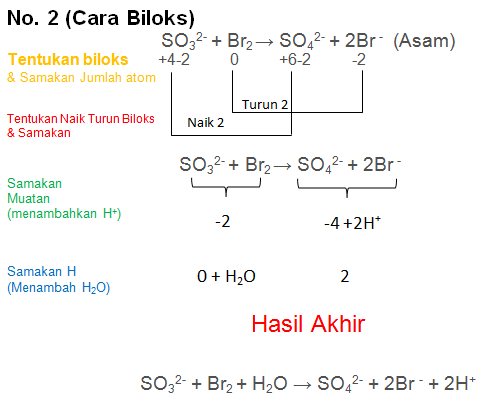
Soal No.29
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
SO32- + Br2 → SO42- + 2Br− (Asam)
SO32- + Br2 → SO42- + 2Br− (Asam)
Soal No.30
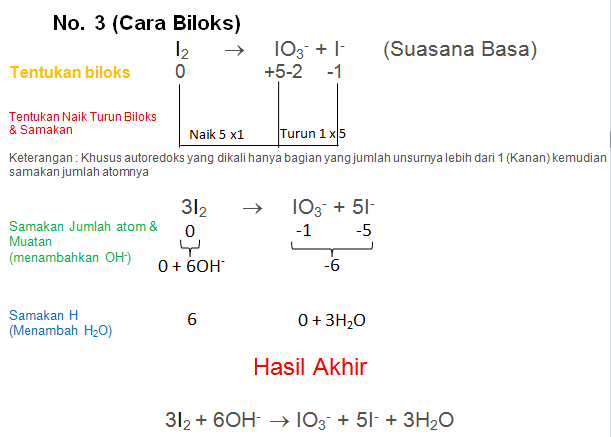
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
I2 → IO3− + I− (Suasana Basa)
I2 → IO3− + I− (Suasana Basa)
Soal No.31
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
Al + NO3− → AlO2− + NH3 (basa)
Al + NO3− → AlO2− + NH3 (basa)
Soal No.32
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
FeS + NO3− → Fe3+ + NO + S (Suasana Asam)
FeS + NO3− → Fe3+ + NO + S (Suasana Asam)
Soal No.33
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
MnO4− + CN− → MnO2 + CNO− (Suasana Basa)
MnO4− + CN− → MnO2 + CNO− (Suasana Basa)
Soal No.34
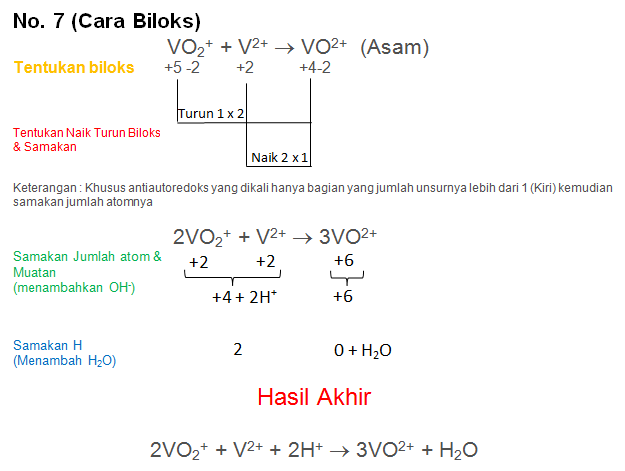
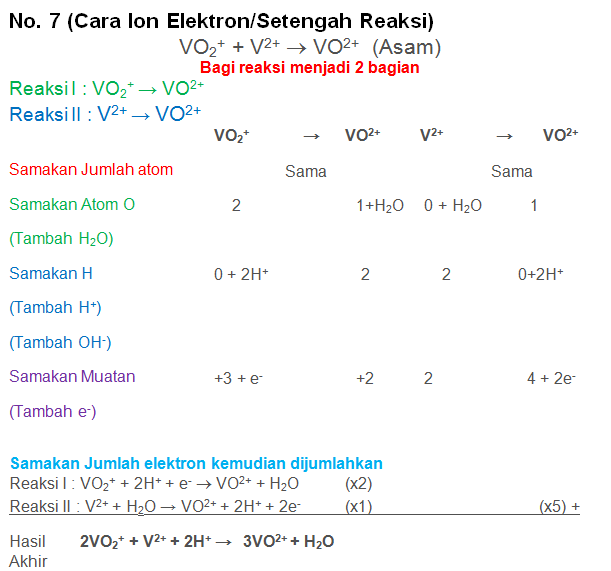
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
VO2+ + V2+ → VO2+ (Asam)
VO2+ + V2+ → VO2+ (Asam)
Soal No.35
Setarakan Reaksi berikut dengan metode biloks atau ion elektron
MnO4− + Mn2+ → MnO2 (Suasana Basa)
MnO4− + Mn2+ → MnO2 (Suasana Basa)
Sumber Soal : Kimia Untuk SMA/MA Kelas XII Penerbit Erlangga Pengarang Unggul Sudarmo