Contoh Soal & Pembahasan UAS Kimia Sem 1 Kelas XII
1. 1 mol NaOH dalam 1 liter air
2. 1 mol urea dalam 1 liter larutan
3. 0,1 mol KOH dalam 100 gram air
4. 11,7 gram NaCl dalam 2000 gram air
5. 18 gram C6H12O6 dalam 100 gram etanol
Larutan-larutan yang konsentrasinya 1 molal (1 m) adalah….
(Ar H = 1; C = 12; O = 16; Na = 23; Cl = 35,5)
- 1, 2 dan 3
- 1, 3 dan 5
- 2, 3 dan 5
- 2 dan 4
- 1 dan 3
Pembahasan:

JAWABAN B
- urea (CO(NH2)2)
- glukosa (C6H12O6)
- natrium klorida (NaCl)
- asam cuka (CH3COOH)
- kalsium klorida (CaCl2
Pembahasan:
Jika konsentrasinya sama, maka zat yang partikelnya paling banyak yaitu larutan elektrolit kuat yang jumlah ionnya lebih banyak. Dari pilihan yang termasuk elektrolit kuat yaitu NaCl dan CaCl2. Larutan elektrolit yang lebih banyak ionnya yaitu CaCl2 yaitu sebanyak 3 ion sedangkan NaCl hanya 2 ion. Jadi yang paling banyak partikelnya yaitu CaCl2
JAWABAN E
- 2%
- 2,04%
- 6,4%
- 6,8%
- 98%
Pembahasan:

JAWABAN C
- 51/50 x 30 mmHg
- 51/25 x 30 mmHg
- 50/52 x 30 mmHg
- 9/10 x 30 mmHg
- 18/19 x 30 mmHg
Pembahasan:
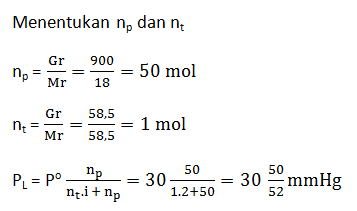
JAWABAN C
- -0,744oC
- -0,558oC
- -0,372oC
- -0,279oC
- -0,26oC
Pembahasan:

JAWABAN B
- 690 gram
- 345 gram
- 115 gram
- 172,5 gram
- 86 gram
Pembahasan:
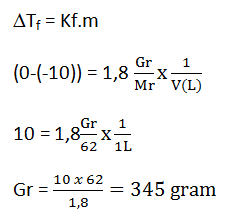
JAWABAN B
- 18
- 36
- 90
- 180
- 100
Pembahasan:
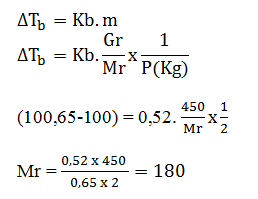
JAWABAN D
 Dari percobaan di atas dapat disimpulkan bahwa titik beku larutan tergantung pada ….
Dari percobaan di atas dapat disimpulkan bahwa titik beku larutan tergantung pada ….- molalitas larutan
- molaritas larutan
- fraksi mol zat larutan
- jumlah partikel zat terlarut
- jenis zat terlarut
Pembahasan:
Dari data percobaan dapat dilihat untuk zat yang memiliki molalitas yang lebih besar memiliki titik beku yang lebih kecil. Tapi untuk yang molalitasnya sama titik beku berbeda disebabkan jumlah zat yang larutnya berbeda. Untuk larutan elektrolit akan memiliki titik beku yang lebih rendah dibanding larutan non elektrolit dengan konsentrasi yang sama. Jadi dari percobaan dapat disimpulkan titik beku tergantung pada jumlah partikel zat terlarut
JAWABAN D
- -7,440 oC
- -3,720 oC
- -0,744 oC
- -0,372 oC
- -0,186 oC
Pembahasan:

JAWABAN B
- 99,8
- 100
- 100,2
- 100,4
- 100,8
Pembahasan:
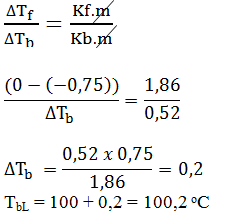
JAWABAN B
- 0,5 mol
- 1 mol
- 1,5 mol
- 2 mol
- 3 mol
Pembahasan:
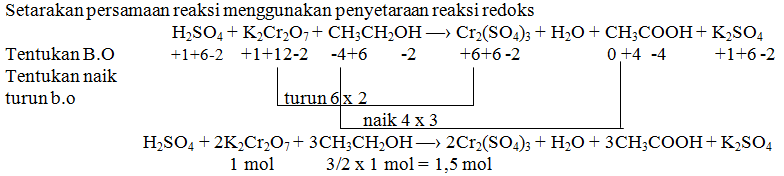
JAWABAN B
- Cu/Cu2+//Ag+/Ag
- Cu2+ /Cu//Ag/Ag+
- Ag+ /Ag//Cu/Cu2+
- Ag/Ag+//Cu/Cu2+
- Ag+ //Cu/Ag/Cu2+
Pembahasan:
2AgNO3(aq) + Cu(s) → 2Ag(s)+Cu(NO3)2
+1+5-2 0 0 +2 +5
Anoda : Cu (mengalami penurunan biloks)
Katoda : Ag (mengalami kenaikan biloks)
Notasi sel : Anoda | ion Anoda || ion Katoda | katoda
Cu | Cu2+ || Ag+ | Ag
JAWABAN A
Mg/Mg2+//Pb2+/Pb Eo = 2,21 volt
Zn/Zn2+//Cu2+/Cu Eo = 1,10 volt
Pb/Pb2+//Cu2+/Cu Eo = 0,47 volt
Maka harga potensial sel dari Mg/Mg2+//Cu2+/Cu adalah ….
- 0,12 volt
- 0,21 volt
- 0,57 volt
- 2,00 volt
- 2,68 volt
Pembahasan:
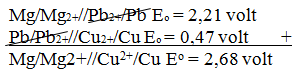
JAWABAN E
Fe2+ + 2e → Fe Eo = -0,44 volt
Ag+ + e → Ag Eo =+0,80 volt
Pernyataan yang benar untuk sel yang disusun dari elektroda besi dan perak adalah ….
- sebagai katodanya adalah Fe
- notasi sel Ag/Ag+//Fe2+/Fe
- katoda Fe mengalami reduksi
- ion Ag+ mengalami reduksi pada katode menjadi Ag
- Harga Eo sel = 2,04 volt
Pembahasan:
Anoda(Oksidasi) : elektroda dengan Eo kecil yaitu Fe
Katoda(Reduksi) : elektroda dengan Eo besar yaitu Ag
Eosel = Eo katoda – Eoanoda = 0,8 – (-0,44) volt = 1,24 volt
Jadi yang benar adalah ion Ag+ mengalami reduksi pada katode menjadi Ag
JAWABAN D
- 4 –log 2
- 4 + log 2
- 2 – log 2
- 2 – log 4
- 4 – log 4
Pembahasan:
Reaksi ionisasi CuSO4
CuSO4 → Cu2+ + SO42-
K : 2Cu2+ + 4e → 2Cu
A : 2H2O → 4H+ + 4e + O2
Mol Cu2+ = M x V = 0,02 M x 0,5 L = 0,01 mol
Mol H+ = 4/2 x 0,01 mol = 0,02 mol
[H+] = n/v = 0,02 mol/0,5 L = 4 x 10-2 M
pH = 2 – log 4
JAWABAN D
- Be
- Na
- Mg
- Rb
- K
Pembahasan:
Energi ionisasi dalam satu golongan dari atas ke bawah semakin kecil, dalam satu periode dari kiri ke kanan semakin besar
Jika dilihat urutan dalam SPU dapat digambarkan sebagai berikut:
Na(496) Mg(738)
K(419)
Rb(403)
Jadi unsur yang energi ionisasinya 738 kJ/mol adalah Mg
JAWABAN C
- potensial ionisasi lebih besar
- jari-jari ion lebih besar
- sifat basa lebih kuat
- reduktor yang lebih kuat
- titik didih lebih rendah
Pembahasan:
IIA golongan yang berada di sebelah kanan golongan IA
Sifat yang dari kiri ke kanan membesar (IIA lebih besar dibanding IA) yaitu:
Energi Ionisasi/potensial ionisasi
Keelektronegatifan
Afinitas elektron
Titik didih (Logam)
Jadi jawaban yang paling tepat adalah potensial ionisasi IIA lebih besar dibanding IA
JAWABAN A
- kulit Mg lebih sedikit dari Na
- subkulit Mg lebih sedikit dari Na
- elektron Mg lebih sedikit dari Na
- proton dalam inti dari Mg lebih banyak dari Na
- proton dalam inti dari Mg lebih kecil dari Na
Pembahasan:
Jari-jari atom dalam satu periode dari kiri ke kanan semakin kecil, hal ini disebabkan proton semakin banyak untuk menarik elektron sehingga jari-jarinya semakin kecil, jadi jawaban yang paling tepat adalah proton dalam inti dari Mg lebih banyak dari Na
JAWABAN D
- Be(OH)2
- Mg(OH)2
- Ca(OH)2
- Sr(OH)2
- Ba(OH)2
Pembahasan:
Yang dijadikan sebagai obat sakit lambung yaitu Mg(OH)2
JAWABAN B
- 1,12 liter
- 2,24 liter
- 4,48 liter
- 22,4 liter
- 44,8 liter
Pembahasan:
Reaksi elektrolisis H2SO4
H2SO4 → 2H+ + SO42-
K : 4H+ + 4e → 2H2
A : 2H2O → 4H+ + 4e + O2
1 F = 1 mol e
4 F = 4 mol e
Mol H2 dapat ditentukan dari perbandingan koefesien dengan e:
Mol H2 = 2/4 x 4 mol = 2 mol
Karena diukur pada keadaan STP, maka:
V = n x 22,4 L = 2 x 22,4 L = 44,8 L
JAWABAN E
- leburan AlCl3 dengan elektroda Pt
- larutan NaCl dengan elektroda C
- leburan KCl dengan elektroda C
- larutan NaOH dengan elektroda C
- larutan KNO3 dengan elektroda Au
Pembahasan:
Logam alkali diperoleh dari elektrolisis leburan garamnya. Dibuat dari leburannya karena di katoda yang bereaksi yaitu logam alkalinya bukan air. Jawaban yang paling tepat adalah dari leburan KCl dengan elektroda C
JAWABAN B
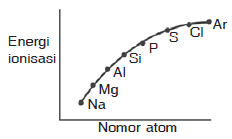
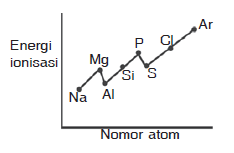
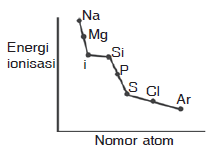
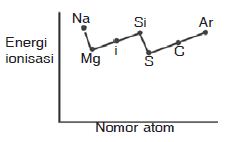
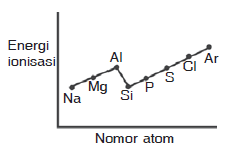
Pembahasan:
Pada umumnya energi ionisasi dalam satu periode dari kiri ke kanan mengalami kenaikan, Namun di periode ketiga terdapat penyimpangan yaitu terjadi kenaikan pada unsur Mg dan P. Kenaikan ini disebabkan konfigurasi Mg yang lebih stabil dibanding Al dan konfigurasi P lebih stabil dibanding S


Jadi grafik yang paling tepat adalah grafik B
JAWABAN B
- 12,8 gram
- 25,6 gram
- 6,4 gram
- 19,2 gram
- 17,0 gram
Pembahasan:
Massa Al2O3 murni = 34,5 gram x 95% = 32,775 gram
Mol Al2O3 = Gr/Mr = 32,775 gr/ 138 = 0,2375 mol
2Al2O3. 2H2O → 4Al + 3O2 + 4 H2O
0,2375 mol
n Al = 4/2 x 0,2375 = 0,475 mol
Gr Al = n x Ar = 0,475 x 27 = 12,8 gram
JAWABAN A
- AlN
- Al2(CO3)2
- Al(OH)3
- Al4O3
- Al2O3
Pembahasan:
Lapisan yang melindungi alumunium dari korosi yaitu oksida alumunium (Al2O3)
JAWABAN E
- konduktor
- oksidator
- reduktor
- isolator
- semikonduktor
Pembahasan:
Silikon digunakan sebagai komponen elektronik yang pengaturan arusnya dapat di atur karena bersifat semikonduktor
JAWABAN E
- Zn hanya mempunyai satu macam bilangan oksidasi
- Zn membentuk ion kompleks
- Zn terdapat pada golongan IB
- Zn mempunyai subkulit 3d yang berisi penuh dengan elektron
- Zn bersifat amfoter
Pembahasan:
Beberapa alasan Zn tidak dimasukan ke dalam golongan:
1. Ionnya tidak berwarna
2. Bersifat diamagnetik
3. Hanya memiliki satu macam biloks
JAWABAN A
- 5 partikel α dan 2 partikel β
- 5 partikel α dan 1 partikel β
- 4 partikel α dan 1 partikel β
- 3 partikel α dan 1 partikel β
- 4 partikel α dan 2 partikel β
Pembahasan:
Sebelah kanan nomor massa kurang 16, maka jumlah 16/4 = 4 α, karena ada 4 maka sebelah kanan kelebihan 1, maka jumlah beta adalah 1.
JAWABAN C
- Fe-59
- Tc-99
- I-131
- Xe-133
- Ti-201
Pembahasan:
Fe-59 : digunakan untuk mempelajari sel darah merah
Tc-99 : Mendeteksi kerusakan tulang dan paru-paru
I-131 :digunakan untuk terapi dan deteksi kelainan kelenjar tiroid
Xe-133 : Mendeteksi Penyakit paru-paru
Ti-201 : mendeteksi kerusakan jantung
JAWABAN C
soal dan pembahasannnya sangat membantu kami belajar kimia