Contoh Soal & Pembahasan Reaksi Kesetimbangan SBMPTN Kimia SMA
- A + B ⇔ C
- A + C ⇔ 2B
- A ⇔ 2B + C
- A ⇔ 4B + 2C
- 5A ⇔ 8B + 4C
PEMBAHASAN :
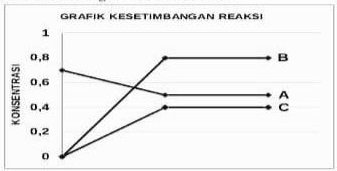
Yang menjadi pereaksi adalah A karena mengalami pengurangan konsentrasi sedangkan produk adalah B dan C karena konsentrasinya bertambah
Jika dituliskan dalam reaksi yaitu sebagai berikut
[A] mula-mula = 0,7 M
[A] setimbang = 0,5 M
[B] mula-mula = 0 M
[B] setimbang = 0,8 M
[C] mula-mula = 0 M
[C] setimbang = 0,4 M

Jika dibandingkan mol pada keadaan reaksi:
mol A : mol B : mol C = 0,2 : 0,8 : 0,4 = 1 : 4 : 2
Perbandingan ini akan sam dengan perbandingan koefisiennya, sehingga:
A ⇔ 4B + 2C
Jawaban D
DOWNLOAD CONTOH SOAL & PEMBAHASAN REAKSI KESETIMBANGAN SBMPTN DALAM BENTUK PDF KLIK DISINI
- 2
- 4
- 6
- 8
- 10
PEMBAHASAN :
Diketahui:Tekanan awal SF6 = 48 torr
Tekanan total = 60 torr

Maka nilai x
P Total = P SF6 + P SF4 + P F2 = 48-x + x + x = 48 + x
60 = 48 + x
x = 12 torr
Maka pada setimbang:
P SF6 = 48 - 12 = 36 torr
P SF4 = P F2 = 12 torr
Sehingga nilai Kp
Jawaban B
- bergeser ke kiri jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- bergeser ke kanan jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- tidak bergeser jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- bergeser ke kiri jika ditambahkan 2 mol H2, 2 mol I2 dan 1 mol HI
- tidak bergeser jika ditambahkan 2 mol H2, 2 mol I2 dan 1 mol HI
PEMBAHASAN :
Kita tentukan terlebih dahulu nilai Kc nya sebelum terjadinya penambahan
![]()
Maka setelah penambahan kita akan menghitung Qc (tetapan kesetimbangan sementara)
Pergeseran kesetimbangan akan ditentukan dari perbandingan nilai Qc dan Kc:
- Jika Qc < Kc Maka jumlah produk masih sedikit sehingga reaksi akan bergeser menuju ke produk atau ke kanan
- Jika Qc = Kc artinya sudah setimbang, tidak akan terjadi pergeseran kesetimbangan.
- Jika Qc > Kc Maka jumlah produk terlalu banya sehingga reaksi akan bergeser menuju ke pereaksi atau ke kiri
Karena masing-masing pilihan berbeda penambahannya, maka Qc dihitung sesuai penambahannya masing-masing
- Pilihan A, B, C penambahan 1 mol H2, 1 mol I2 dan 1 mol HI

Karena Qc < Kc maka reaksi akan bergeser ke kanan - Pilihan D, E penambahan 2 mol H2, 2 mol I2 dan 1 mol HI

Karena Qc < Kc maka reaksi akan bergeser ke kanan
Maka jawaban yang tepat adalah B bergeser ke kanan jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
Jawaban B
- 0,133
- 0,278
- 0,555
- 0,755
- 1,333
PEMBAHASAN :
Kita tentukan nilai m,r,s nya:

Diketahui P total = 1,75 atm, maka nilai x:
P total = (1-x) + (1-½x) + x
1,75 = 2 - ½x
½x = 0,25
x = 0,5
Maka tekanan parsial masing-masing zat:
P F2 = 1 - x = 1 - 0,5 = 0,5 atm
P O2 = 1 - ½x = 1 - ½.0,5 = 0,75 atm
P OF2 = x = 0,5 atm
Menentukan Kp
![]()
Jawaban E
- 0,10 M
- 0,12 M
- 0,15 M
- 0,20 M
- 0,30 M
PEMBAHASAN :
Kita tentukan nilai Kc sebelum penambahan konsentrasi NH3 dan HCl
![]()
Nilai Kc akan tetap sama jika ditambah NH3 0,4 M dan HCl 0,2 M (karena volume = 1 L, maka mol sama dengan molaritasnya)

![]()
Kedua sisi di akar 4 kan

![]()
0,5(0,2 - x) = (0,1 + x)
0,1 - 0,5 x = 0,1 + x
1,5 x = 0
x = 0
Maka konsentrasi P(NH2)3 saat setimbang = 0,1 + x = 0,1 + 0 = 0,1 M
Jawaban A
- untuk meningkatkan hasil reaksi (NH3), maka dapat dilakukan dengan cara menaikkan suhu.
- reaksi pembentukan amonia adalah reaksi eksotermis
- perubahan entalpi reaksi peruraian amonia berharga negatif
- produk peruraian amonia terjadi lebih besar pada suhu rendah
- penambahan katalis akan menaikkan harga tetapan kesetimbangan
PEMBAHASAN :
Dari data di atas jika suhu dinaikan maka nilai Kc dan Kp menjadi lebih kecil. Kita tau bahwa Kc dan Kp berbading lurus dengan jumlah produk dan berbanding terbalik dengan jumlah pereaksi artinya jika Kc atau Kp makin kecil maka jumlah produk menjadi sedikit atau pereaksi bertambah atau dikatakan reaksi sedang bergeser ke kiri (menuju pereaksi) kalau suhu dinaikan. Hal ini disebabkan karena pembentukan amonia bersifat eksoterm. Jika dituliskan persamaan termokimianya.
3H2(g) + N2(g) ![]() 2NH3 (g) ΔH = -x kJ
2NH3 (g) ΔH = -x kJ
Jawaban B
- 3000 atm
- 3100 atm
- 3011 atm
- 3101 atm
- 3111 atm
PEMBAHASAN :
Pada suhu 25 oC reaksi tersebut memiliki Kp = 9 x 105, Maka untuk mengetahui tekanan total sistem kita akan mencari tekanan parsial NH3 dari nilai Kp.
![]()
(P NH3)2 = 9 x 106
![]()
Maka tekanan totalnya = P NH3 + P N2 + P H2 = 3.000 + 10 + 1 = 3.011 atm
Jawaban C
- tekanan total gas pada keadaan kesetimbangan adalah 80 atm
- setelah tercapai kesetimbangan tekanan parsial gas N2O4 adalah 64 atm
- nilai Kp > 4 pada suhu di atas 400 K
- pada kondisi kesetimbangan tekanan parsial NO2 dua kali tekanan parsial N2O4
PEMBAHASAN :
- Yang diketahui hanya kondisi tekanan mula-mula N2O4, untuk yang reaksi dimisalkan dengan x



288 - 4x = 4x2
4x2 + 4x - 288 = 0
x2 + x - 72 = 0
(x + 9)(x - 8) = 0
x = -9 atau x = + 8
x yang paling mungkin adalah x = +8
Maka saat kesetimbangan
P N2O4 = 72 - x = 72 - 8 = 64 atm
PNO2 = 2x = 2 x 8 = 16 atm
maka P total = PN2O4 + PNO2 = 64 + 16 = 80 atm
BENAR - Sesuai perhitungan no.1 PN2O4 saat setimbang = 64 atm. BENAR
- Reaksi dekomposisi merupakan contoh dari reaksi endoterm. Jika suhu dinaikan di atas 400 K, maka reaksi akan bergeser ke reaksi endoterm atau menuju ke produk. Maka tekanan produk akan bertambah besar dan nilai Kp akan menjadi lebih besar dari 4. BENAR
- Saat setimbang, PNO2 = 16 atm dan PN2O4 = 64 atm, maka PNO2 = 1/4 PN2O4. SALAH
Jawaban A
- 0,2
- 0,5
- 1,0
- 2,0
- 5,0
PEMBAHASAN :
Kita tuliskan keadaaan m,r,s nya
mol H2 dan I2 di reaksi = 0,1 karena perbandingan mol dan koefisien dengan HI
Karena volumenya (V) = 5 L, maka nilai Kc

Jawaban C
- 2,0 x 10-2
- 4,0 x 10-2
- 1,0 x 10-3
- 2,0 x 10-3
- 4,0 x 10-3
PEMBAHASAN :
Rumusan Kp hanya memasukan wujud gas saja. Maka tekanan total berasal dari penjumlahan PNH3 dan PCO2 karena berwujud gas. Maka PNH3 dan PCO2 dari perbandingan koefisien/perbandingan mol.
![]()
Maka nilai Kp nya
Kp = (PNH3)2. PCO2 = (0,2)2.0,1 = 0,004 = 4 x 10-3
Jawaban E
DOWNLOAD CONTOH SOAL & PEMBAHASAN REAKSI KESETIMBANGAN SBMPTN DALAM BENTUK PDF KLIK DISINI
 tanya-tanya.com Jika bisa gratis kenapa harus bayar
tanya-tanya.com Jika bisa gratis kenapa harus bayar