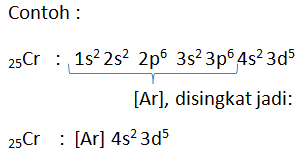DAFTAR ISI
Kelemahan Teori Atom Bohr
Teori Atom Bohr memiliki beberapa kelemahan, diantaranya:
- Hanya menjelaskan Spektrum atom Hidrogen
- Tidak dapat menjelaskan spektrum atom Hidrogen memiliki garis-garis tambahan (Efek Zeeman dan Efek Strack).
Teori Dasar Munculnya Teori Atom Modern
Dualisme de Broglie:
“Elektron dapat bertindak sebagai partikel juga sebagai gelombang”.
Prinsip Ketidakpastian Heisenberg:
“Elektron tidak ditemukan secara pasti di dalam lintasan tetapi hanya kebolehjadian”.
Daerah Kebolehjadian ditemukannya elektron disebut Orbital
LIHAT JUGA :
| Latihan Soal Struktur Atom | Video Struktur Atom | Tempat Nanya |
| Klik Disini | Klik Disini | Klik Disini |
| Rangkuman Struktur Atom | Contoh Soal I | |
| Klik Disini | Klik Disini |
Persamaan Schrödinger
“Schrödinger membuat persamaan gelombang yang didasari pernyataan de broglie”.persamaannya:
Persamaan ini memperkirakan daerah kebolehjadian ditemukannya elektron (Orbital).
DOWNLOAD RANGKUMAN STRUKTUR ATOM MODERN DALAM BENTUK PDF KLIK DISINI
Bilangan Kuantum
- Bilangan kuantum merupakan gambaran kedudukan elektron dalam suatu atom dan membedakannya dengan elektron lainnya.
- Bilangan kuantum diperoleh dari penurunan persamaan Schrödinger.
- Bilangan kuantum memiliki 4 jenis, diantaranya bilangan kuantum utama (n), Bilangan kuantum azimut (l ), Bilangan kuantum magnetik (m) dan Bilangan kuantum spin (s)
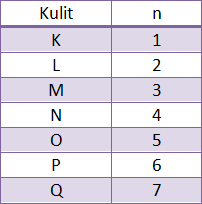
Bilangan kuantum utama (n)
menunjukkan kulit yang ditempati elektron
Bilangan kuantum azimut (l )
Menunjukan sub kulit yang ditempati elektron
Hubungan kulit (n) dengan subkulit (l):
lmaks = (n-1)
Bilangan kuantum magnetik (m)
Menunjukan orientasi elektron dalam orbital
Hubungan azimuth (l) dengan magnetik (m):
m = -l, 0, +l
Hubungan ini juga dapat menentukan jumlah orbital masing-masing sub kulit, satu orbital akan diisi maksimal oleh 2 elektron.
Bilangan kuantum spin (s)
Menunjukan arah rotasi elektron
satu orbital diisi oleh maksimal dua elektron, satu mengarah ke atas (s = + ½ ), satu lagi mengarah ke bawah (s= - ½)
Penulisan bilangan kuantum dalam konfigurasi elektron
Contoh soal
- Tentukan harga n dan l elektron yang terletak pada orbital :
- 4s
- 3d
- Tuliskan ke 4 bilangan kuantum yang mungkin pada orbital :
- 4p
- 3d
- 4f
Jawaban
1.
- n = 4 (kulit ke-4), dan l = 0 (subkulit s)
- n = 3 (kulit ke-3), dan l = 2 (subkulit d)
2.
- n = 4, l = 1, m = -1, 0, +1 , s = +½, -½
- n = 3, l = 2, m = -2,-1, 0, +1,+2 , s = +½, -½
- n = 4, l = 3, m = -3,-2,-1, 0, +1,+2,+3 , s = +½, -½
Bentuk Orbital
Orbital s
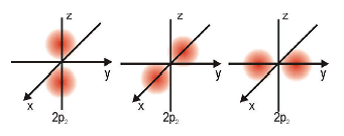
Orbital p
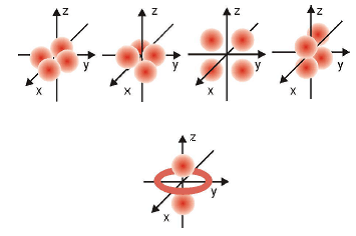
Orbital d
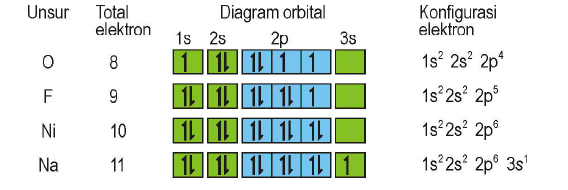
Konfigurasi Elektron
Tiga Aturan konfigurasi atom modern :
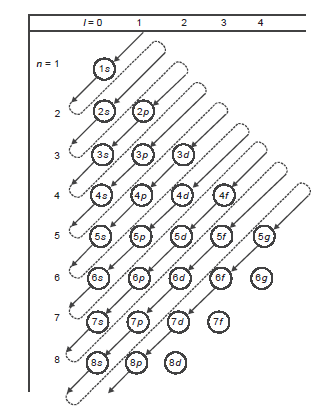
Aturan Aufbau (Membangun)
“Pengisian elektron dimulai dari orbital yang tingkat energinya lebih rendah kemudian ke tingkat energi yang lebih tinggi”
Urutan subkulit dari energi terendah sampai tertinggi yaitu sebagai berikut:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, …dst
Cara cepat menghapal:
Contoh soal:
Tuliskan konfigurasi elektron atom berikut dengan lengkap:
12Mg : 1s2 2s2 2p6 3s2
20Ca : 1s2 2s2 2p6 3s2 3p6 4s2
30Zn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
23V : 1s2 2s2 2p6 3s2 3p6 4s2 3d3
14Si : 1s2 2s2 2p6 3s2 3p2
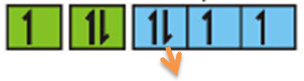
Aturan Hund
“Pengisian elektron pada orbital yang setingkat energinya mula-mula elektron diisi dengan tidak berpasangan terlebih dahulu sesudah diisikan baru kemudian berpasangan”
Contoh soal:
Larangan Pauli
Elektron yang menghuni orbital tidak boleh memiliki ke 4 bilangan kuantum yang sama. n, l, m boleh sama tetapi bilangan kuantum s akan berbeda.
Contoh Soal
Tentukan ke 4 bilangan kuantum elektron terakhir dari unsur berikut:
8O : 1s2 2s2 2p4
Elektron yang terakhir di tulis
Bilangan kuantumnya:
n = 2, l = 1, m = -1, s = -1/2
Cara Menulis Konfigurasi Singkat
Konfigurasi elektron bisa disingkat menggunakan konfigurasi elektron gas mulia
Konfigurasi gas mulia
2He : 1s2
10Ne : 1s2 2s2 2p6
18Ar : 1s2 2s2 2p6 3s2 3p6
36Kr : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
86Rn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
Menentukan dengan lebih cepat:
Caranya:
- Tentukan gas mulia yang dijadikan penyingkat, nomor atom gas mulia harus lebih kecil dari nomor atom yang ditentukan
- Lanjutkan konfigurasi elektron dari gas mulia, caranya:
Sesudah : [He] 2s2
[Ne] 3s2
[Ar] 4s2
[Kr] 5s2
[Xe] 6s2
[Rn] 7s2
Contoh:
Tentukan konfigurasi elektron dengan singkat
- 22Ti
- 17 Cl
- 53 I
- 22Ti, nomor atomnya 22 dibawahnya ada [18Ar], tersisa tinggal 4 elektron lagi sehingga menjadi 22Ti : [Ar] 4s2 3d2
- 17Cl, nomor atomnya 17 dibawahnya ada [10Ne], tersisa tinggal 7 elektron lagi sehingga menjadi 17Cl : [Ne] 3s2 3p5
- 53I, nomor atomnya 53 dibawahnya ada [36Kr], tersisa tinggal 17 elektron lagi sehingga menjadi 53I : [Kr] 5s2 4d10 5p5
Kestabilan subkulit d terisi penuh dan setengah penuh
Sesuai aturan Aufbau Konfigurasi Cr (24) dan Cu (29) adalah :
24Cr : [Ar] 4s2 3d4
29Cr : [Ar] 4s2 3d9
Kenyataannya ini kurang stabil, yang betul adalah:
24Cr : [Ar] 4s1 3d5
29Cr : [Ar] 4s1 3d10
Hal ini disebabkan karena kondisi 3d4 kurang stabil dibandingkan 3d5, begitu pula 3d9 kurang stabil dibanding 3d10
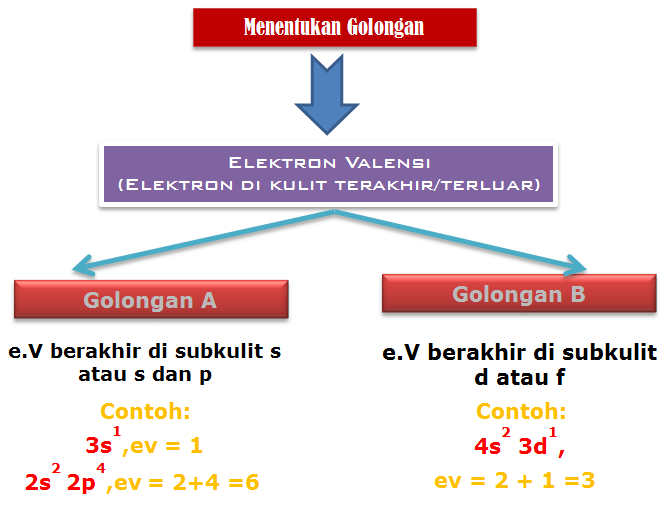
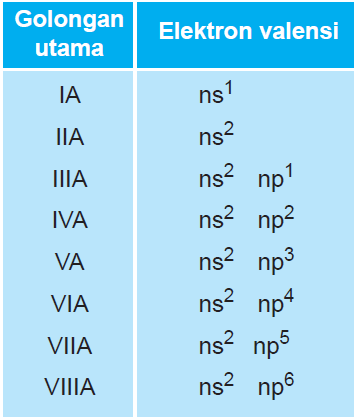
Menentukan Golongan dan Periode
Penentuan Golongan A (Utama)
Jumlah elektron valensi merupakan golongan unsur tersebut
Contoh :
- 11Na : 1s2 2s2 2p6 3s1,ev= 1 Golongan = IA
- 8O : 1s2 2s2 2p4,ev = 2+4 =6 Golongan = VI A
Penentuan Periode
Periode ditentukan dari kulit terluar
Contoh:
- 11Na : 1s2 2s2 2p6 3s1, kulit terluar =3 Periode = 3
- 8O : 1s2 2s2 2p4, kulit terluar =2 Periode = 2
Penentuan Golongan B (Transisi)
Jumlah elektron di sub kulit s terakhir dan d merupakan golongan unsur tersebut
Contoh:
- 21Sc : [Ar] 4s2 3d1,ev= 2 + 1 = 3 Golongan = III B
- 30Zn : [Ar] 4s2 3d10,ev= 2 + 10 = 12 Golongan = I B
Penentuan Periode
- 21Fe : [Ar] 4s2 3d1,kulit terakhir = 4 Periode = 4
- 48Cd : [K4] 5s2 4d10,kulit terakhir = 5 Periode = 5
DOWNLOAD RANGKUMAN STRUKTUR ATOM MODERN DALAM BENTUK PDF KLIK DISINI
LIHAT JUGA :
| Latihan Soal Struktur Atom | Video Struktur Atom | Tempat Nanya |
| Klik Disini | Klik Disini | Klik Disini |
| Rangkuman Struktur Atom | Contoh Soal I | |
| Klik Disini | Klik Disini |