Contoh Soal & Pembahasan UTS Kimia Kelas XII Bag.II
Suatu sel Volta tersusun dari elektroda Sn dan elektroda Fe yang dicelupkan dalam larutan ion logamnya dengan konsentrasi 1 M. Bila diketahui potensial elektroda Sn dan Fe sebagai berikut:
Fe2+ (aq) + 2e → Fe(s) Eo = -0,44 volt
Sn2+ (aq) + 2e → Sn(s) Eo = -0,14 volt
a. Gambarkan diagram sel volta tersebut
b. Tentukan anoda dan dan katodanya
c. Tentukan arah aliran elektronnya
d. Tentukan nilai potensial selnya
e. Tuliskan notasi selnya
a. Gambar diagram sel volta
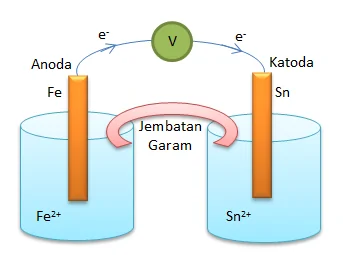
b. Anoda : Fe (dilihat dari Eonya yang lebih kecil)
d. Nilai potensial sel
Fe | Fe2+ || Sn2+ | Sn
A | A2+ || D2+ | D Eo = +0,74 volt
A | A2+ || 2B+ | 2B Eo = +1,2 volt
2C | 2C+ || E2+ | E Eo = +2,58 volt
E | E2+ || 2B+ | 2B Eo = +0,93 volt
H2 | 2H+ || E2+ | E Eo = – 0,13 volt
a. Tentukan potensial elektroda A, B, C dan D
b. Urutkan daya oksidasi setiap logam dari yang paling kuat daya oksidasinya sampai yang paling lemah
c. Tentukan notasi sel yang terjadi jika elektroda E dipasangkan dengan elektroda A
a. diketahui bahwa Eo H2 = 0 volt, maka dari notasi sel ke 5 dapat ditentukan Eo E:
-0,13 v = Eo E – 0
Eo E = – 0,13 v
Menentukan Eo B dari notasi sel ke 4
Eosel = Eo B – Eo E
+0,93 v = Eo B – (-0,13 v)
Eo B = +0,8 v
Menentukan Eo C dari notasi sel ke 3
Eosel = Eo E – Eo C
+2,58 v = -0,13 – Eo C
Eo C = -2,71 v
Menentukan Eo A dari notasi sel ke 2
Eosel = Eo B – Eo A
+1,20 v = +0,8 v – Eo A
Eo A = – 0,4 v
Menentukan Eo D dari notasi sel ke 1
Eosel = Eo D – Eo A
+0,74 v = Eo D – (-0,4 v)
Eo D = +0,34 v
c. notasi sel jika elektroda E dan A dipasangkan:
A | A2+ || E2+ | E Eo = +0,27 volt
LIHAT JUGA : Contoh Soal & Pembahasan UTS Kelas XII Bag. I
PEMBAHASAN :
karena Y dan Z dapat membebaskan gas hidrogen artinya Y dan Z berada di sebelah kiri H dalam deret volta, X dapat membebaskan Y artinya X berada disebelah kiri Y dalam deret volta. dan hanya Z yang dapat membebaskan hidrogen dari air artinya Z paling kiri di deret volta dibanding X dan Y, jadi urutan di deret volta
Z – X – Y
sedangkan berdasarkan daya reduksi yang makin menurun susunannya tetap
Z – X – Y
PEMBAHASAN :
Persamaan : Sel volta dan elektrolisis reaksi yang terjadi di katoda sama-sama mengalami reaksi reduksi dan di anoda sama-sama mengelami reaksi oksidasi
Perbedaan :
Sel Volta
– Katoda (+), Anoda (-)
– mengubah reaksi redoks menjadi energi listrik
– berlangsung spontan
Elektrolisis
– Katoda (-), Anoda (+)
– mengubah energi listrik menjadi reaksi redoks
– tidak berlangsung spontan
a. Lelehan Al2O3 dengan elektroda grafit
b. Larutan NiSO4 dengan elektroda Fe pada katoda dan Nikel pada anoda
PEMBAHASAN :
Persamaan : Sel volta dan elektrolisis reaksi yang terjadi di katoda sama-sama mengalami reaksi reduksi dan di anoda sama-sama mengelami reaksi oksidasi
Perbedaan :
Sel Volta
– Katoda (+), Anoda (-)
– mengubah reaksi redoks menjadi energi listrik
– berlangsung spontan
Elektrolisis
– Katoda (-), Anoda (+)
– mengubah energi listrik menjadi reaksi redoks
– tidak berlangsung spontan
a. Tuliskan reaksi yang terjadi
b. Berapa waktu elektrolisis yang dilakukan
c. Berapa liter gas yang dihasilkan di anoda jika diukur pada suhu dan tekanan yang sama dimana 2 liter gas nitrogen monoksida massanya 1,5 gram (Ar N = 14; O = 16)?
d. Berapa pH larutan setelah elektrolisis jika volume larutan 500mL
a. Reaksi elektrolisis larutan AgNO3
Katoda (-) : 4Ag+ + 4e → 4Ag
Anoda (+) : 2H2O → 4H+ + 4e + O2(g)
mol O2 = 1/4 x 0,2 mol = 0,05 mol
pada P dan T yang sama berlaku:
n NO = 1,5/30 = 0,05 mol
sehingga volume O2
V O2 = 2 L
mencari mol H+ dari perbandingan koefisien dengan mol Ag
mol H+ = 4/4 x 0,05 mol = 0,05 mol
[H+] = n/v = 0,05 mol/ 0,5L = 10-1 M
pH = 1
PEMBAHASAN :
karena menggunakan arus secara seri berlaku hukum Faraday II, untuk menentukan massa perak ditentukan dari rumus:
![]()
![]()

w Ag = 21,6 gram
untuk menentukan massa besi ditentukan dari rumus:
![]()
![]()

w Fe = 3,73 gram