Pembahasan Soal SBMPTN Saintek Kimia Tahun 2018
PEMBAHASAN :
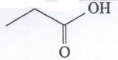
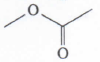
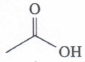
Senyawa pada soal merupakan senyawa alkohol yang memiliki gugus fungsi OH. Beberapa jenis senyawa alkohol berdasarkan letak gugus OH nya adalah
- Alkohol primer : alkohol yang gugus OH nya menempel pada C primer (C yang berikatan pada 1 atom C lainnya). Alkohol ini jika dioksidasi akan menjadi aldehid dan kemudian akan teroksidasi kembali menjadi asam karboksilat.
- Alkohol sekunder : alkohol yang gugus OH nya menempel pada C sekunder (C yang berikatan pada 2 atom C lainnya). Alkohol ini jika dioksidasi akan menjadi keton.
- Alkohol tersier : alkohol yang gugus OH nya menempel pada C tersier (C yang berikatan pada 3 atom C lainnya). Alkohol ini tidak dapat dioksidasi.
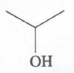
Senyawa alkohol ini termasuk alkohol sekunder karena menempel pada C sekunder (C yang menempel pada 2 atom C lainnya). Sehingga jika dioksidasi maka akan menjadi keton.
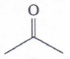
Jawaban C
DOWNLOAD PEMBAHASAN SOAL SBMPTN SAINTEK KIMIA TAHUN 2018 DALAM BENTUK PDF KLIK DISINI
- 1,2,3, dan 4
- 1,2, dan 3
- 1 dan 3
- 2 dan 4
- hanya 4
PEMBAHASAN :
Ciri senyawa polar:
- memiliki keelektronegatifan yang berbeda antara atom-atom penyusun senyawa tersebut. Contoh H-Cl. H memiliki keelektronegatifan yang rendah sedangkan Cl memiliki keelektronegatifan yang tinggi.
- Memiliki bentuk molekul yang tidak lurus (Asimetris)
- Memiliki PEB. Adanya PEB menyebabkan bentuk molekul menjadi tidak lurus (asimetris)
- Momen dipol ≠ 0
Dari ciri tersebut senyawa yang termasuk senyawa polar adalah no 2 dan 4. Pada senyawa 2 terdapat atom Cl yang memiliki keelektronegatifan yang tinggi sehingga menyebabkan keelektronegatifan akan lebih tertarik ke Cl sehingga momen dipolnya ≠ 0. Pada senyawa no. 4 Adanya PEB (pasangan elektron bebas) yang dimiliki oleh atom pusat N yang menyebabkan bentuk molekul menjadi asimetris.
Jawaban D
- 6,7 x 1025
- 6,0 x 1023
- 0,9 x 1022
- 5,4 x 1021
- 3,0 x 1021
PEMBAHASAN :
Menentukan massa Cl dalam senyawa
massa Cl =
Menentukan jumlah atom Cl
JP = n x L
- 8,6 g
- 32 g
- 60 g
- 62 g
- 90 g
PEMBAHASAN :
Menentukan mol Si2H6 dan O2
![]()
![]()
Menentukan pereaksi pembatas (pereaksi yang menjadi patokan untuk membandingkan dengan mol zat yang lain)
Pereaksi pembatas = cari yang terkecil. Dan yang menjadi pereaksi pembatas yaitu Si2H6, Di bagian reaksi tinggal dibandingan koefisiennya dengan zat yang lain
2Si2H6(g) + 7O2(g) → 4SiO2(s) + 6H2O(l)
0,75 4
Maka mol SiO2
![]()
Maka massa SiO2 yang dihasilkan adalah
Gr SiO2 = n x Mr = 1,5 x 60 = 90 gr
Jawaban E
- 200 mL
- 300 mL
- 400 mL
- 500 mL
- 600 mL
PEMBAHASAN :
Menurut hukum Gay perbandingan volume akan sebanding dengan perbandingan koefisien. Jika diketahui volume CO2 yang dihasilkan sebanyak 200 mL maka volume H2O dapat diketahui melalui perbandingan dengan koefisien
![]()
Maka volume total dari hasil reaksi adalah = V CO2 + V H2O = 200 + 300 = 500 mL
Jawaban D
- 143 kJ mol-1
- 243 kJ mol-1
- 253 kJ mol-1
- 343 kJ mol-1
- 361 kJ mol-1
PEMBAHASAN :
Menentukan perubahan entalpi menggunakan data energi ikatan dapat menggunakan rumusan:
ΔHr = (Energi ikatan pemutusan) - (Energi ikatan pembentukan) = (Ei Kiri) - (Ei Kanan)
Untuk menetukan perubahan entalpinya kita terlebih dahulu membuat rumus struktur zat yang terlibat dalam reaksi:
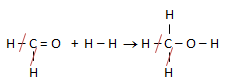
Jika ada ikatan yang sama di kiri dan di kanan maka dapat di coret. Dari reaksi tersebut di dapat:
ΔHr = (C=O + H-H) - (C-H + C-O + O-H)
9 kJ/mol = (799 + 432) - (416 + C-O + 463)
9 = (1231) - (879 + C-O)
879 + C-O = 1222
C-O = 1222 - 879 = 343 kJ/mol
Jawaban D
JIka 0,3 mol gas brom terdisproporsionisasi secara sempurna, jumlah mol elektron yang terlibat adalah…
- 0,1
- 0,2
- 0,3
- 0,4
- 0,5
PEMBAHASAN :
Reaksi tersebut sudah disetarakan tinggal menentukan jumlah elektron yang terlibat
Jumlah elektron yang terlibat dilihat dari naik turun biloks yaitu 5. Jumlah elektron = 5 untuk mol Br2 = 3 mol (dilihat dari koefisien). Maka untuk 0,3 mol dapat ditentukan jumlah elektronnya melalui perbandingan:
Jawaban E
- Cd adalah katoda
- Ni(OH)2 terbentuk di katoda
- Cd(OH)2 terbentuk di katoda
- Ni adalah anoda
- Reaksi berlangsung pada pH < 7
PEMBAHASAN :
Menentukan katoda dan anoda dapat dilihat dari perubahan biloks dari reaksi sel yang diketahui di soal
Cd(s) + NiO2(s) + 2H2O(l) → Ni(OH)2(s) + Cd(OH)2(s)
0 +4 +2 +2
- Cd mengalami kenaikan biloks (oksidasi) berarti Cd bertindak sebagai anoda
- Ni mengalami penurunan biloks (reduksi) berarti NiO2 bertindak sebagai katoda
- Ni(OH)2 akan terbentuk di katoda
- Cd(OH)2 akan terbentuk di anoda.
- Karena dihasilkan senyawa yang bersifat basa (Ni(OH)2 dan Cd(OH)2 maka reaksi berlangsung pada pH > 7
Maka jawaban yang paling tepat adalah B
Jawaban B
- 4,8 x 10-2 s-1
- 3,6 x 10-2 s-1
- 3,2 x 10-2 s-1
- 2,4 x 10-2 s-1
- 1,6 x 10-2 s-1
PEMBAHASAN :
Menentukan laju pembentukan H2
![]()
Maka kita dapat menentukan laju penguraian PH3 melalui perbandingan dengan koefisien:
![]()
Saat [PH3] = 0,1 M maka nilai K
![]()
(tanda - artinya laju penguraian atau berkurang)
0,0016 M/s = k. (0,1 M)
![]()
Jawaban E
- 2
- 4
- 6
- 8
- 10
PEMBAHASAN :
Diketahui:Tekanan awal SF6 = 48 torr
Tekanan total = 60 torr

Maka nilai x
P Total = P SF6 + P SF4 + P F2 = 48-x + x + x = 48 + x
60 = 48 + x
x = 12 torr
Maka pada setimbang:
P SF6 = 48 - 12 = 36 torr
P SF4 = P F2 = 12 torr
Sehingga nilai Kp
Jawaban B
- 100
- 250
- 400
- 700
- 1400
PEMBAHASAN :
Jika ada dua larutan yang diketahui maka kita bisa membandingkannya untuk menentukan Mr zat organik
Karena ΔTb B = 2. ΔTb A, dan nilai Kb akan sama karena pelarutnya sama. Nilai i untuk larutan BaCl2 adalah 3 sesuai dengan jumlah ionnya.
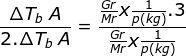
Jawaban B
- 9,5
- 10,0
- 11,5
- 12,5
- 13,0
PEMBAHASAN :
HCN merupakan asam lemah dan KOH merupakan basa kuat. Jika ada asam dan basa maka reaksikan terlebih dahulu.
Menentukan mol HCN
n = M x V = 0,1 M x 200 mL = 0,1 M x 0,2 L= 0,02 mol
Menentukan mol KOH
![]()

Karena kedua pereaksi habis maka termasuk hidrolisis yang ditinjau adalah garam. Garam yang di hasilkan dari reaksi HCN dan KOH akan bersifat basa karena terbentuk dari basa kuat dan asam lemah (hidrolisis lihat siapa yang kuat)
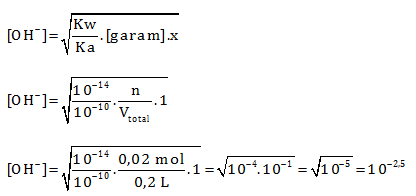
pOH = 2,5
pH = 14 – 2,5 = 11,5
Jawaban A
- CH3OH dan CH3O-
- HC2H3O2 dan HCO3-
- C6H5NH2 dan C6H5NH3-
- C2H3O2- dan HC2H3O2
- HCO3- dan CO32-
PEMBAHASAN :
Asam Basa menurut Bronsted-Lowry
Asam : Pemberi/donor proton (H+) → berkurang di akhir 1 H+
Basa : Penerima/akseptor proton (H+) → bertambah di akhir 1 H+
Perubahan dari asam menjadi basa konjugasi yaitu akan mengalami pengurangan sebanyak 1 H+
- CH3OH dan CH3O- : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HC2H3O2 dan HCO3- : : Bukan merupakan pasangan asam-basa konjugasi karena jumlah H nya tidak memiliki selisih 1 H+ dan jumlah atom lainnya berbeda
- C6H5NH2 dan C6H5NH3+ : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- C2H3O2- dan HC2H3O2 : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
- HCO3- dan CO32- : Merupakan pasangan asam-basa konjugasi karena selisih 1 H+
Jawaban yang tepat adalah B
Jawaban B
- 1-metil siklopentana
- 1-etil siklopentana
- 2-bromo-2-pentena
- 2-hidroksi pentana
- 3-kloro pentana
PEMBAHASAN :
Senyawa yang bersifat optis aktif adalah senyawa yang memiliki C kiral yaitu C yang keempat tangannya mengikat atom atau gugus fungsi yang berbeda
1-metil siklopentana
![]()
Tidak memiliki C kiral
1-etil siklopentana
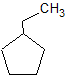
Tidak memiliki C kiral
2-bromo-2-pentena
CH3-CBr=CH-CH2-CH3
Tidak memiliki C Kiral
2-hidroksi pentana
CH3 - *CHOH-CH2 - CH2 - CH3
Memiliki 1 atom C Kiral (yang bertanda *)
3-kloro pentana
CH3 - CH2 - CHCl- CH2 - CH3
Tidak memiliki C Kiral
Jadi senyawa yang memiliki isomer optis aktif adalah D
Jawaban D
- XCl3
- X2O3
- XCl2
- XO3
- XCl4
PEMBAHASAN :
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron. Semakin tinggi energi ionisasi maka semakin sulit melepas elektron. Pada energi ionisasi ke lima kenaikannya terlalu drastis. Sehingga dapat diperkirakan atom tersebut mampu melepa elektron sampai melepaskan 4 e sedangkan untuk melepaskan atom yang ke 5 terlalu sulit karena energi ionisasinya terlalu besar. Maka ion yang paling mungkin adalah X4+ jika di ikatkan dengan Cl- akan membentuk senyawa XCl4
Jawaban E
DOWNLOAD PEMBAHASAN SOAL SBMPTN SAINTEK KIMIA TAHUN 2018 DALAM BENTUK PDF KLIK DISINI
 tanya-tanya.com Jika bisa gratis kenapa harus bayar
tanya-tanya.com Jika bisa gratis kenapa harus bayar