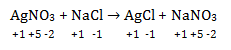Contoh Soal Reaksi Reduksi dan Oksidasi (Redoks) Kelas 10
Soal No.1
Tentukan bilangan oksidasi atom Mn pada senyawa:
- Mn
- MnO2
- MnSO4
- MnO4–
- MnO42-
PEMBAHASAN :
- b.o Mn = 0
- b.o Mn + b.o O x 2 = 0 b.o Mn + (-2) x 2 = 0 b.o Mn = +4
- MnSO4 → Mn2+ + SO42- b.o Mn = +2
- b.o Mn + b.o O x 4 = -1 b.o Mn + (-2) x 4 = -1 b.o Mn = +8 – 1 = +7
- b.o Mn + b.o O x 4 = -2 b.o Mn + (-2) x 4 = -2 b.o Mn = +8 – 2 = +6
Soal No.2
Tentukan bilangan oksidasi setiap atom pada senyawa/ ion di bawah ini:
- N2O3
- NaNO3
- K2Cr2O7
- CrO42-
- PO43-
PEMBAHASAN :
- b.o N x 2 + b.o O x 3 = 0 2.b.o N + (-2) x 3 = 0 b.o N = +6/2 = + 3
- b.o Na x 1 + b.o N x 1 + b.o O x 3 = 0 +1 + b.o N + (-2) x 3 = 0 b.o N = +6 – 1 = +5
- b.o K x 2 + b.o Cr x 2 + b.o O x 7 = 0 +2 + 2. b.o Cr + (-2) x 7 = 0 2.b.o Cr = +14 – 2 = +12 b.o Cr = +12/2 = +6
- b.o Cr + b.o O x 4 = -2 b.o Cr + (-2) x 4 = -2 b.o Cr = +8 – 2 = + 6
- b.o P + b.o O x 4 = -3 b.o P + (-2) x 4 = -3 b.o P = +8 – 3 = +5
Soal No.3
Termasuk reaksi reduksi atau oksidasikah perubahan berikut?
- MnO4– → Mn2+
- SO32- → SO42-
- VO+ → VO2+
- Fe3+ → Fe2+
PEMBAHASAN :
- MnO4– → Mn2+ +7 +2 Terjadi penurunan bilangan oksidasi maka termasuk reduksi
- SO32- → SO42- +4 +6 Terjadi kenaikan bilangan oksidasi maka termasuk oksidasi
- VO+ → VO2+ +3 +5 Terjadi kenaikan bilangan oksidasi maka termasuk oksidasi
- Fe3+ → Fe2+ +3 +2 Terjadi penurunan bilangan oksidasi maka termasuk reduksi
Soal No.4
Apakah reaksi-reaksi di bawah ini termasuk reaksi redoks?
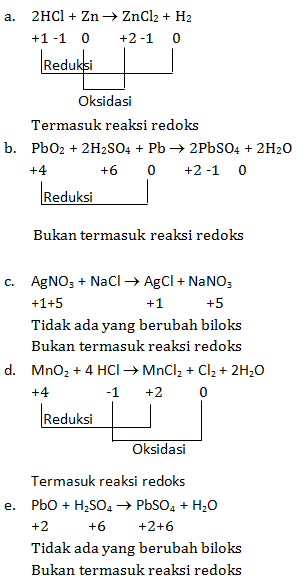
- 2HCl + Zn → ZnCl2 + H2
- PbO2 + 2H2SO4 + Pb → 2PbSO4 + 2H2O
- AgNO3 + NaCl → AgCl + NaNO3
- MnO2 + 4 HCl → MnCl2 + Cl2 + 2H2O
- PbO + H2SO4 → PbSO4 + H2O
Soal No.5
Tunjukan reaksi oksidasi dan reaksi reduksi dari persamaan reaksi berikut
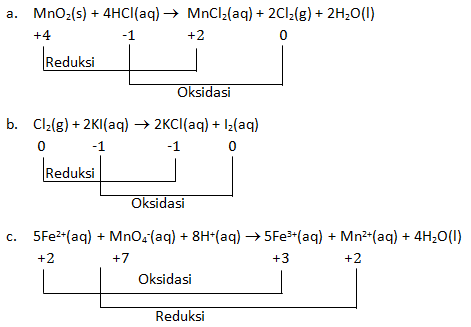
- MnO2(s) + 4HCl(aq) → MnCl2(aq) + 2Cl2(g) + 2H2O(l)
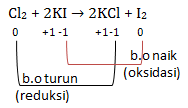
- Cl2(g) + 2KI(aq) → 2KCl(aq) + I2(aq)
- 5Fe2+(aq) + MnO4–(aq) + 8H+(aq) → 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
Soal No.6
Tunjukkan reaksi oksidasi dan reduksinya, serta pengoksidasi dan pereduksinya
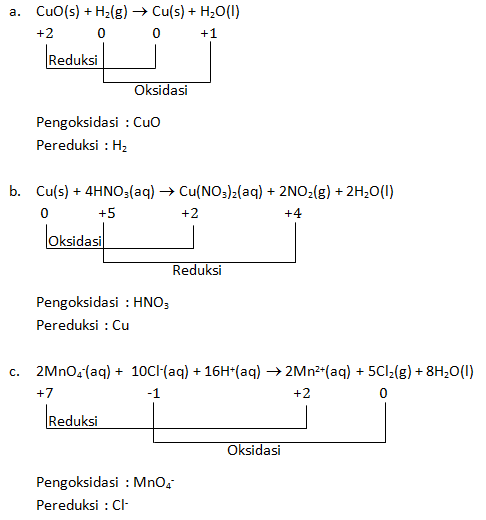
- CuO(s) + H2(g) → Cu(s) + H2O(l)
- Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O(l)
- 2MnO4–(aq) + 10Cl–(aq) + 16H+(aq) → 2Mn2+(aq) + 5Cl2(g) + 8H2O(l)
Soal No.7
Tentukan bilangan oksidasi (biloks) setiap atom pada senyawa/ion di bawah ini:
- NH4NO3
- H2O2
- N2O3
- MnO42-
- PO43-
PEMBAHASAN :
- NH4NO3, senyawa harus dibagi dua dulu, sesuai ion yang terbentuk
NH4NO3 → NH4+ + NO3–
Menentukan b.o N dalam NH4+
b.o N x 1 + b.o H x 4 = +1
b.o N + (1) x 4 = +1 b.o N = -3
Menentukan b.o N dalam NO3–
b.o N x 1 + b.o O x 3 = -1
b.o N + (-2) x 3 = -1
b.o N = +5 - H2O2
b.o H x 2 + b.o O x 2 = 0
(+1) x 2 + b.o O x 2 = 0
(masukan pertama kali b.o H karena prioritas lebih tinggi
2b.o O = -2
b.o O = -1 - N2O3
b.o N x 2 + b.o O x 3 = 0
b.o N x 2 + (-2) x 3 = 0
b.o N x 2 – 6 = 0
2b.o N = +6
b.o N = +3 - MnO42-
b.o Mn x 1 + b.o O x 4 = -2
b.o Mn + (-2) x 4 = -2
b.o Mn – 8 = -2
b.o Mn = +6 - PO43-
b.o P x 1 + b.o O x 4 = -3
b.o P + (-2) x 4 = -3
b.o P – 8 = -3
b.o P = +5
Soal No.8
Tentukan oksidator, reduktor, hasil oksidasi dan hasil reduksi pada reaksi redok berikut
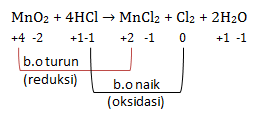
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
- MnO2 mengalami penurunan biloks sehingga mengalami reaksi reduksi atau sebagai OKSIDATOR
- HCl mengalami kenaikan biloks sehingga mengalami reaksi oksidasi atau sebagai REDUKTOR
- hasil oksidasi adalah zat di produk akibat mengalami reaksi oksidasi yaitu Cl2
- hasil reduksi adalah zat di produk akibat mengalami reaksi reduksi yaitu MnCl2
Soal No.9
Tentukan apakah reaksi berikut termasuk reaksi redoks atau bukan
a. AgNO3 + NaCl → AgCl + NaNO3
b. Cl2 + 2KI → 2KCl + I2
PEMBAHASAN :

tidak ada zat yang mengalami kenaikan atau penurunan biloks sehingga bukan termasuk reaksi redoks
Termasuk reaski redoks karena ada zat yang mengalami kenaikan dan penurunan biloks
Soal No.10
Diketahui persamaan reaksi redoks
KMnO4(aq) + KI(aq) + H2SO4(aq) → MnSO4(aq) + I2(aq) + K2SO4(aq) +H2O(l)
Dari reaksi tersebut tentukan oksidator, reduktor hasil reduksi dan hasil oksidasi.
PEMBAHASAN :

Reduktor = KI
Oksidator = KMnO4
Hasil reduksi = MnSO4
Hasil Oksidasi = I2
Soal No.11
Suatu arus listrik mengendapkan 0,62 gram perak dari larutan AgNO3. Jika arus yang sama dilewatkan pada larutan CaCl2, maka massa Ca yang diendapkan adalah … (Ag = 108 dan Ca = 40).
- 0,5 gr
- 1 gram
- 0,2 gr
- 0,1 gr
- 1,5 gr
PEMBAHASAN : Diketahui: Bilangan oksidasi Ag pada AgNO3 = + 1 Bilangan oksidasi Ca pada CaCl2 = + 2
Massa Ag = 0,62 gram Maka massa Ca dapat dihitung sebagai berikut: MAg : MCa = eAg : eCa 0,62 gr : MCa =  0,62 gr : MCa = 108 : 20
0,62 gr : MCa = 108 : 20
MCa = 0,1 gr Jawaban D
Soal No.12
Jika arus listrik 20 ampere dilewatkan selama 15 menit ke dalam larutan AgNO3, maka masa perak adalah …
- 18,5 gr
- 20,1 gr
- 15,5 gr
- 10,0 gr
- 5,8 gr
PEMBAHASAN : Diketahui: Bilangan oksidasi Ag pada AgNO3 = + 1 Massa ekuivalen Ag (e) = 108
Waktu elektrolisis (t) = 15 menit = 900 detik
Arus listrik (i) = 20 Ampere Maka massa Ag dapat dihitung sebagai berikut: 
 MAg = 20,1 gr
MAg = 20,1 gr
Jawaban B
Soal No.13
Berikut ini merupakan ciri-ciri sel volta, kecuali …
- Energi kimia berubah menjadi energi listrik
- Katoda bermuatan positif
- Anoda bermuatan negatif
- Anoda tempat reaksi oksidasi
- Energi listrik berubah menjadi energi kimia
PEMBAHASAN : Ciri-ciri sel Volta/ Galvani:
- Energi kimia berubah menjadi energi listrik
- Katoda bermuatan positif dan anoda bermuatan negatif
- Anoda tempat reaksi oksidasi dan katoda tempat reaksi reduksi
Ciri-ciri sel elektrolisis:
- Energi listrik berubah menjadi energi kimia
- Katoda bermuatan negatif dan anoda bermuatan positif
- Anoda tempat reaksi oksidasi dan katoda tempat reaksi reduksi
Jawaban E
Soal No.14
Berikut ini yang mengalami reaksi oksidasi adalah …
- I¯ (aq) berubah menjadi I2 (aq)
- Ag+ (aq) berubah menjadi Ag (s)
- CI2 (g) berubah menjadi CI¯ (aq)
- Cr+6 berubah menjadi CrO4 -2
- H2O (l) berubah menjadi OH¯ (aq)
PEMBAHASAN : Reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi. Maka unsur yang mengalami reaksi oksidasi, sebagai berikut:
- I¯ (aq) berubah menjadi I2 (aq) → I¯ = -1 menjadi I2 = 0 (oksidasi)
- Ag+ (aq) berubah menjadi Ag (s) → Ag+ = +1 menjadi Ag = 0 (reduksi)
- CI2 (g)berubah menjadi CI¯ (aq) → CI2 = 0 menjadi CI¯ = -1 (reduksi)
- Cr6+ berubah menjadi CrO4 -2 → Cr6+ = +6 menjadi CrO4 -2 = 6 (tidak terjadi reaksi redoks)
- H2O (l) berubah menjadi OH¯ (aq) → H2O = +1 menjadi OH¯ (reduksi)
Jawaban A
Soal No.15
Senyawa berikut ini yang memiliki bilangan oksidasi Br tertinggi adalah …
- AlBr3
- Ca(BrO)2
- Fe(BrO2)3
- HBrO4
- PbBr4
PEMBAHASAN : Menentukan bilangan oksidasi unsur Br sebagai berikut:
- AlBr3 → Br¯ → x = -1, bilangan oksidasi = -1
- Ca(BrO)2 → BrO¯ → x – 2 = -1 → x = +1, bilangan oksidasi = +1
- Fe(BrO2)3 → BrO2¯ → x – 4 = -1 → x = +3, bilangan oksidasi = +3
- HBrO4 → BrO4¯ → x – 8 = -1 → x = +7, bilangan oksidasi = +7
- PbBr4¯ → x = -1, bilangan oksidasi = -1
Jawaban D