Soal UTBK 1 Kimia Tahun 2019 Dan Pembahasannya Part I
Diketahui reaksi :
3HOCl + NaI → NaIO3 + 3HCl
Dalam suatu larutan NaI 0,05 M dan 100 ml HOCl hasil pengenceran dari 5 ml larutan HOCl 3 M
- 3 mol
- 4 mol
- 5 mol
- 6 mol
- 7 mol
PEMBAHASAN :

Maka untuk 1 mol NaI (koefisiennya 1) akan terlibat 6 elektron
Jawaban D
DOWNLOAD SOAL UTBK I KIMIA TAHUN 2019 & PEMBAHASANNYA DALAM BENTUK PDF KLIK DISINI
- 0,03 M
- 0,05 M
- 0,15 M
- 0,30 M
- 0,50 M
PEMBAHASAN :
Sebelum pengenceran:
M1 = 3 M
V1 = 5 ml
Maka setelah pengenceran:
M1.V1 = M2.V2
3 M. 5 ml = M2. 100 ml
![]()
Jawaban C
LIHAT JUGA : Soal UTBK I Kimia 2019 Part II
- 0,015 M
- 0,025 M
- 0,030 M
- 0,050 M
- 0,075 M
PEMBAHASAN :
Karena berlangsung secara sempurna, maka kedua pereaksi akan habis.
n HOCl = M x V = 0,15 M x 100 ml = 15 mmol
n NaI = M x V = 0,05 M . x ml = 0,05 x mmol

Menentukan Volume NaI
0,05.x = 5
x = 5/0,05 = 100 ml
Maka molaritas HCl yang didapat adalah
![]()
Jawaban E
Sebanyak 25 ml larutan metilamina (CH3NH2) 0,04 M (Kb = 4 x 10-4) dititrasi dengan larutan HCl 0,02 M
pH larutan CH3NH2 sebelum dititrasi adalah….
- 3 – 2 log 2
- 5 – 2 log 4
- 9 + 2 log 4
- 10 + 2 log 2
- 11 + 2 log 2
PEMBAHASAN :
metilamina termasuk kedalam basa lemah (memiliki Kb) maka pH sebelum dititrasi adalah:
![]()
pOH = 3 – log 4
pH = 14 – (3 – log 4) = 11 + log 4 = 11 + 2 log 2
Jawaban E
- 6 – log 2
- 6 + log 2
- 8 – log 2
- 8 + log 2
- 10 + 2 log 2
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 25 ml = 0,5 mmol
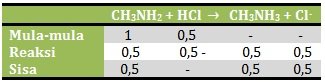
Karena yang bersisa adalah basa lemah dan asam konjugasinya maka akan membentuk larutan penyangga basa, yang pH nya
![]()
pOH = 4 – log 4
pH = 10 + log 4 = 10 + 2 log 2
Jawaban E
- 2
- 3
- 4
- 5
- 6
PEMBAHASAN :
n CH3NH2 = M x V = 0,04 M x 25 ml = 1 mmol
n HCl = M x V = 0,02 M x 55 ml = 1,1 mmol
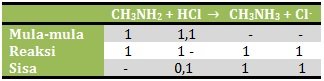
Karena yang bersisa adalah asam kuat maka pH dihitung dengan rumus asam kuat
![]()
[H+] = a. Ma = 1. 0,00125 M = 0,00125 M
Kemudian larutan diencerkan sampai 100 ml
M1. V1 = M2. V2
0,00125M. 80 ml = M2. 100 ml
![]()
maka pH = 3
Jawaban B
Diketahui reaksi:
6H+ + 5SO32- + 2MnO4– → 5SO42- + 2Mn2+ + 3H2O
Dalam suatu reaksi digunakan 100 ml larutan H2SO3 0,1 M dan 100 ml KMnO4 yang didapat dari pengenceran 5 ml KMnO4 2 M
- 2 mol
- 5 mol
- 7 mol
- 10 mol
- 14 mol
PEMBAHASAN :

Jumlah elektron untuk 5 mol SO32- sesuai dengan koefisennya = 5 adalah 10 mol elektron
Jawaban D
- 0,01 M
- 0,05 M
- 0,1 M
- 0,15 M
- 0,20 M
PEMBAHASAN :
Sebelum pengenceran:
M1 = 2 M
V1 = 5 ml
Maka setelah pengenceran:
M1.V1 = M2.V2
2 M. 5 ml = M2. 100 ml
![]()
Jawaban C
Ikatan antar monomer dalam amilum adalah..
- peptida
- fosfodiester
- glikosida
- amida
- ester
PEMBAHASAN :
Ikatan antar monomer dalam amilum adalah glikosida.
- Peptida adalah ikatan antar monomer asam amino pembentuk protein.
- Fosfodiester ikatan dalam asam nukleat pada DNA
Jawaban C
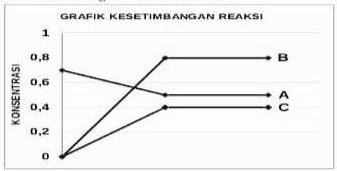
- A + B ⇔ C
- A + C ⇔ 2B
- A ⇔ 2B + C
- A ⇔ 4B + 2C
- 5A ⇔ 8B + 4C
PEMBAHASAN :
Yang menjadi pereaksi adalah A karena mengalami pengurangan konsentrasi sedangkan produk adalah B dan C karena konsentrasinya bertambah
Jika dituliskan dalam reaksi yaitu sebagai berikut
[A] mula-mula = 0,7 M
[A] setimbang = 0,5 M
[B] mula-mula = 0 M
[B] setimbang = 0,8 M
[C] mula-mula = 0 M
[C] setimbang = 0,4 M
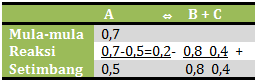
Jika dibandingkan mol pada keadaan reaksi:
mol A : mol B : mol C = 0,2 : 0,8 : 0,4 = 1 : 4 : 2
Perbandingan ini akan sam dengan perbandingan koefisiennya, sehingga:
A ⇔ 4B + 2C
Jawaban D
DOWNLOAD SOAL UTBK I KIMIA TAHUN 2019 & PEMBAHASANNYA DALAM BENTUK PDF KLIK DISINI