Hi there! kali ini kita mau kasih kamu pembahasan sifat koligatif larutan yang super lengkap. Ada rangkuman materinya, bagian-bagian materi yang wajib kamu kuasai di bab ini. Trus kita tambahkan video pembelajarannya, gratis! Untuk penguasan yang lebih mendalam kita kasih 100+ contoh soal & jawaban berikut pembahasannya lengkap! Ok, silahkan kamu pilih bagian mana yang kamu mau tuju terlebih dahulu di daftar isi yah. Kamu juga bisa tanyakan soal yang sulit di komentar yah fren!
DAFTAR ISI
Rangkuman Materi Sifat Koligatif Larutan Kelas 12
Dibagian ini ada ringkasan materi dan rumus-rumus sifat koligatif yang musti kamu kuasai yah! Selamat menjelajah.
Konsentrasi
Banyaknya zat terlarut dalam sejumlah zat pelarut/larutan.
Fraksi mol (X)

Dimana:
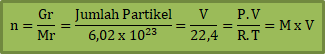
Fraksi mol menyatakan perbandingan jumlah mol komponen suatu zat terhadap total mol semua komponen yang terdapat dalam larutan
Jika larutan hanya terdiri dari dua komponen, zat A dan zat B, berlaku:
![]()
Molalitas (m)
Banyaknya zat terlarut di dalam satu kilogram (1000 gram) pelarut.

P = berat pelarut
Gr = massa zat terlarut (gr)
Mr = massa molekul relatif zat terlarut
Trik Supercepat
Jika diketahui di soal persentase (%) zat terlarut, maka kamu bisa pakai rumus ini:
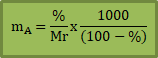
Dimana:
% = persentase zat terlarut
Mr = Massa molekul zat terlarut
Molaritas (M)
Banyaknya zat terlarut di dalam satu liter larutan.

Gr = massa zat terlarut (gr)
Mr = massa molekul relatif terlarut
V = volume larutan
Trik Supercepat
Jika diketahui di soal kadar (%) zat terlarut, massa jenis larutan (ρ) dan Mr zat terlarut maka kamu bisa pakai rumus ini:
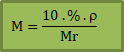
Dimana:
% = kadar zat terlarut
Mr = Massa molekul zat terlarut
ρ = massa jenis larutan
Sifat Koligatif Larutan
Pengertian Sifat Koligatif Larutan
Sifat larutan yang tidak bergantung pada jenis zat terlarut, tetapi bergantung pada konsentrasi/jumlah partikel zat terlarut.
Sifat Koligatif Larutan Non Elektrolit
Penurunan Tekanan Uap (∆P)
- Tekanan yang ditimbulkan oleh uap yang terbentuk dari zat cair yang berubah membentuk fasa gas.
- Penambahan zat terlarut non volatile (sukar menguap) dapat menyebabkan penurunan tekanan uap. Karena partikel pelarut akan terhalang ketika akan menguap.

- Jika tekanan uap pelarut (Po) dan tekanan uap larutan (PL). Maka berlaku :

- Besar penurunannya (∆P) adalah :

- Hubungan penurunan tekanan uap (∆P) dengan fraksi mol (X)
Francois M. Raoult menjelaskan hubungan PL dengan X melalui hukum Raoult dalam
persamaan :

Xp = fraksi mol pelarut
Karena Xp + Xt = 1, maka diperoleh rumusan:

Xt = fraksi mol terlarut - Trik Super Cepat
Menentukan Mr dari sifat koligatif penurunan tekanan uap

Keterangan :
Gr = massa terlarut
Po = tekanan uap pelarut
Pl = tekanan uap larutan
np = mol pelarut
Kenaikan Titik Didih (∆Tb)
- Akibat tekanan uap larutan mengalami penurunan dari tekanan uap pelarut, maka titik didih larutan akan lebih tinggi dibandingkan titik didih pelarut.
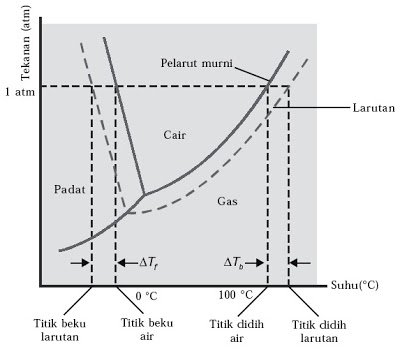
- Dengan penambahan zat terlarut. Titik didih larutan akan lebih tinggi dibandingkan titik didih pelarut. Hal ini dapat dijelaskan dengan diagram fasa:

Sumber gambar : nafiun.com - Jika titik didih pelarut (Tbo) dan titik didih larutan (TbL). Maka berlaku :

Besar kenaikan titik didih (∆Tb) adalah :

Tbo air = 100oC
Tb L > 100oC - Hubungan kenaikan titik didih dengan konsentrasi (molalitas):

Kb = Tetapan Kenaikan titik didih molal (air = 0,52oC/m)
Penurunan Titik Beku (∆Tf)
- Dengan penambahan zat terlarut. Titik beku larutan akan lebih rendah dibandingkan titik beku pelarut. Hal ini dapat dijelaskan dengan diagram fasa.
- Jika titik beku pelarut (Tfo) dan titik beku larutan (TfL). Maka berlaku :

Besar penurunan titik beku (∆Tf) adalah :

Tfo air = 0oC
Tf L < 0oC - Hubungan penurunan titik beku dengan konsentrasi (molalitas):

Kf = Tetapan Penurunan titik beku molal (air = 1,86oC/m)
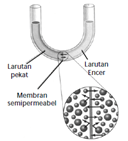
Tekanan osmosis (π)
- Osmosis adalah proses perpindahan larutan yang memiliki konsentrasi rendah melalui membran semipermeabel menuju larutan yang memiliki konsentrasi lebih tinggi hingga tercapai kesetimbangan konsentrasi.

- Tekanan yang diterapkan untuk menghentikan proses osmosis dari larutan encer atau pelarut murni ke dalam larutan yang lebih pekat disebut tekanan osmotik larutan.
- Rumusan tekanan osmosis:

Keterangan:
π = Tekanan Osmosik
M = Molaritas
R = Tetapan Gas Umum (0,082 L atm/k mol)
Sifat Koligatif Larutan Elektrolit
Ket: n = jumlah ion , α= derajat ionisasi
Rumusan Sifat Koligatif Larutan Elektrolit:

100+ Contoh Soal Sifat Koligatif Larutan Jawaban & Pembahasannya Kelas 12
Soal No.1
Apa yang dimaksud dengan sifat koligatif larutan?
PEMBAHASAN :
Sifat larutan yang tidak bergantung pada jenis zat terlarut, tetapi bergantung pada konsentrasi/jumlah partikel zat terlarut.
Soal No.2
Apakah larutan elektrolit mempunyai sifat koligatif yang sama dengan larutan non elektrolit? Jelaskan.
PEMBAHASAN :
Sifat koligatif larutan elektrolit dengan larutan non elektrolit berbeda karena memiliki jumlah partikel terlarut yang berbeda dengan konsentrasi yang sama
Soal No.3
Tentukanlah kemolalan larutan yang dibuat dengan melarutkan 10 gram urea dalam 100 gram air (Mr urea = 60)
PEMBAHASAN :
![]()
![]()
Soal No.4
Hitunglah kemolalan larutan cuka yang mengandung 24% massa CH3COOH (Ar H = 1 ; C = 12; O = 16)
PEMBAHASAN :
![]()
![]()
Soal No.5
Hitunglah kadar (% massa) glukosa dalam larutan glukosa 1 molal (Mr glukosa = 180)
PEMBAHASAN :
![]()
![]()
180(100 − %) = 1000%
18000 − 180% = = 1000%
18000 = 1180%
![]()
Soal No.6
Berapakah fraksi mol urea dalam suatu larutan yang mengandung 12 gram urea (CO(NH2)2) dalam 90 gram air? (Ar H = 1; C = 12; N = 14; O = 16)
PEMBAHASAN :
![]()
![]()
![]()
![]()
Soal No.7
Tentukan fraksi mol urea (Mr = 60) dalam larutan urea 10%
PEMBAHASAN :
misal 100% = 100 gram, maka massa 10 % urea = 10 gram urea, sedangkan massa air = 100 − 10 = 90 gram
![]()
![]()
![]()
![]()
Soal No.8
Tentukan kadar larutan glukosa, jika diketahui fraksi mol glukosa sebesar 0,2
PEMBAHASAN :
![]()
n glukosa = 1 mol
Gr glukosa = n x Mr glukosa = 1 mol x 180 = 180 gr
n air = 5-1 = 4 mol
Gr air = n x Mr air = 4 x 18 = 72 gr
![]()
![]()
Soal No.9
Tentukan kemolalan larutan yang mengandung 10 gram NaCl dalam 200 mL air ( massa jenis air = 1 g/mL)
PEMBAHASAN :
massa air = ρ x V = 1 g/ml x 200 ml = 200 gr
![]()
![]()
Soal No.10
Hitunglah kemolalan larutan yang dibuat dengan melarutkan 31 mL glikol (C2H6O2) dalam 90 mL air. Kedua jenis cairan itu mempunyai massa jenis 1 kg/L (Ar H = 1; C = 12; O = 16)
PEMBAHASAN :
massa glikol = ρ x V = 1 g/ml x 31 ml = 31 gr
massa air = ρ x V = 1 g/ml x 90 ml = 90 gr
![]()
![]()
Soal No.11
Larutan 6 gram urea dalam 200mL air dicampur dengan 12 gram urea dalam 300 mL air. Hitunglah kemolalan larutan-larutan itu sebelum dan sesudah dicampurkan (Mr urea = 60)
PEMBAHASAN :
sebelum dicampurkan
![]()
![]()
![]()
Setelah dicampurkan
![]()
Soal No.12
Tentukan kemolalan larutan glukosa 18 % (Mr glukosa =180)
PEMBAHASAN: :
![]()
![]()
Soal No.13
Tentukan kadar urea dalam larutan urea 1 molal (Mr urea = 60)
PEMBAHASAN :
![]()
![]()
6000-60% = 1000%
6000 = 1060%
![]()
Soal No.14
Tentukan fraksi mol NaNO3 dalam larutan yang mengandung 10 gram NaNO3 dalam 250 mL air (Ar Na = 23, Ar N = 14, Ar O = 16)
PEMBAHASAN :
massa air = ρ x V = 1 g/ml x 250 ml = 250 gr
![]()
![]()
![]()
![]()
Soal No.15
Hitunglah fraksi mol urea dalam larutan 2 molal
PEMBAHASAN :
2 molal bisa diartikan 2 mol urea dalam 1 kg air
jadi n urea = 2mol
![]()
![]()
![]()
Soal No.16
Sebanyak 20 gram kristal NaOH dilarutkan dalam 100 mL air. Jika NaOH mengion sempurna, hitunglah fraksi mol total ion-ion (fraksi mol Na+ + fraksi mol OH−) dalam larutan (Ar H = 1;O = 16; Na = 23)
PEMBAHASAN :
![]()
![]()
nNaOH = nNa+ = nOH−=0,5 mol
![]()
![]()
![]()
![]()
Soal No.17
Apa yang dimaksud dengan:
a. uap jenuh
b. tekanan uap jenuh
PEMBAHASAN :
a. uap dengan jumlah yang banyak dimana pada keadaan jenuh penguapan bersamaan dengan pengembunan dengan laju yang sama
b. tekanan uap jenuh tekanan yang ditimbulkan oleh uap jenuh suatu zat
Soal No.18
Pada suhu yang sama, manakah yang mempunyai tekanan uap lebih besar, air atau alkohol? Jelaskan jawaban anda.
PEMBAHASAN :
Alkohol akan lebih mudah menguap di bandingkan air jika pada suhu yang sama. Sehingga jumlah uap alkohol akan lebih banyak dan menyebabkan tekanan uap alkohol lebih besar
Soal No.19
Tekanan uap air pada 29o adalah 30 mmHg, tentukan:
- tekanan uap larutan urea 20% (Mr urea = 60)
- tekanan uap larutan urea 1 molal
PEMBAHASAN :
- misalkan 100 % urea = 100 gram
maka 20% urea = 20 gr urea
massa air = 80 gr


Pl=Po.xp

- 1 molal berarti 1 mol urea dalam 1 kg air

Pl=Po.xp

Soal No.20
Hitunglah titik didih dan titik beku larutan glikol 20% berdasar massa. (Mr glikol = 62; Kb dan Kf berturut-turut adalah 0,52oC/m dan 1,86 oC/m)
PEMBAHASAN :
Menghitung molalitas terlebih dahulu
![]()
![]()
Menentukan titik beku glikol
ΔTf = Kf.m
ΔTf = 1,86. 4,03
ΔTf = 7,49
Tfo-Tfl= 7,49
Tfl = − 7,49oC
Menentukan titik didih glikol
ΔTb = Kb.m
ΔTb = 0,52. 4,03
ΔTb = 2,09
Tbl-Tbo= 2,09
Tbl= 102,09oC
Soal No.21
Tentukan titik didih dan titik beku larutan 32 gram belerang, S8, dalam 400 gram asam asetat. Asam asetat murni mendidih pada 118,3 oC dan membeku pada 16,6 oC pada tekanan 1 atm (Kb CH3COOH = 3,1 oC/m; Kf CH3COOH = 3,6 oC/m; Ar S = 32)
PEMBAHASAN :
menentukan molalitas
![]()
![]()
menentukan titik didih larutan
ΔTb = Kb.m
ΔTb = 3,1. 0,312
ΔTb = 0,967 oC
Tbl-Tbo= 0,967
Tbl= 118,3 + 0,967 = 119,267oC
menentukan titik beku larutan
ΔTf = Kf.m
ΔTf = 3,6. 0,312
ΔTf = 1,12 oC
Tfo-Tfl = 1,12
Tfl= 16,6 − 1,12 = 15,48oC
Soal No.22
Di suatu daerah pegunungan, air mendidih rata-rata pada 96 oC. Tekanan uap air jenuh pada 96 oC adalah 657,6 mmHg
- Berapa tekanan udara rata-rata di daerah tersebut?
- Berapa gram urea harus dilarutkan dalam 1 kg air sehingga mendidih pada 100 oC (Kb air = 0,52 oC/m; Mr urea = 60)
PEMBAHASAN :
- Ketika mendidih tekanan uap air sama dengan tekanan udara. Karena tekanan uap air = 657,6 mmHg maka tekanan udaranya pun 657,6 mmHg
- ΔTb = Kb.m




Soal No.23
Suatu larutan mendidih pada 100,2 oC. Tentukan titik beku larutan itu. (Kb air = 0,52 oC/m; Kf air = 1,86 oC/m )
PEMBAHASAN :
Untuk menentukan titik beku larutan kita cari lewat perbandingan:
![]()
molalitas di coret karena sama
![]()
![]()
Tfl = -0,71 oC
Soal No.24
Tentukanlah tekanan osmotik larutan yang tiap liternya mengandung 0,6 gram urea pada suhu 25 oC (Mr urea = 60)
PEMBAHASAN :
π = M.R.T
![]()
![]()
Soal No.25
Berapa gram glukosa (Mr= 180) diperlukan untuk membuat 500 mL larutan dengan tekanan osmotik 1 atm pada suhu 25oC
PEMBAHASAN :
π = M.R.T
![]()
![]()
![]()
Soal No.26
Hitunglah tekanan osmotik larutan yang mengandung 17,1 gram sukrosa (Mr = 342) dalam 1 liter larutan pada 27oC
PEMBAHASAN :
π = M.R.T
![]()
![]()
Soal No.27
Tekanan osmotik darah manusia pada 37oC adalah 7,7 atm. Berapa gram glukosa (Mr = 180) diperlukan untuk membuat 200 mL larutan yang isotonik dengan darah?
PEMBAHASAN :
isotonik artinya memiliki tekanan osmotik sama
π1 = π2
![]()
![]()
Gr = 10,9 gr
Soal No.28
Jika dianggap mengion sempurna (nilai i = nilai teoritis), tentukanlah titik didih dan titik beku larutan 11,7 gram NaCl dalam 1 liter air Kb air = 0,52 oC/m; Kf air = 1,86 oC/m
PEMBAHASAN :
mencari molalitas terlebih dahulu
![]()
![]()
NaCl merupakan elektrolit kuat sehingga i = n = 2
ΔTb = Kb.m.i
ΔTb = 0,52.0,2.2
ΔTb = 0,208
Tbl-Tbo= 0,208
Tbl= 100 + 0,208 = 100,208oC
menentukan titik beku larutan
ΔTf = Kf.m.i
ΔTf = 1,86. 0,2.2
ΔTf = 0,744 oC
Tfo-Tfl = 0,744
Tfl= 0 − 0,744 = -0,744oC
Soal No.29
Sebanyak 1,8 gram suatu basa bervalensi 2 M(OH)2, dilarutkan dalam 100 mL air. Larutan ini mendidih pada 100,2 oC. Jika basa itu mengion 80% hitunglah massa atom relatif logam pembentuk basa tersebut. (Kb air = 0,52 oC/m, Ar H = 1; O = 16)
PEMBAHASAN :
ΔTb = Kb.m.i
100,2-100 = 0,52.m.(1 + (n-1)α)
0,2 = 0,52.m(1+(3-1)0,8)
![]()
![]()
![]()
![]()
Mr = Ar M x 1 + Ar O x 2 + Ar H x 2
122,5 = Ar M + 32 + 2
Ar M = 122,5 − 34
Ar M = 88.5
Soal No.30
Ke dalam 1 liter air dilarutkan 60 gram urea (Mr = 60); 11,7 gram NaCl (Mr = 58,5) dan 11,1 gram CaCl2 (Mr = 111).Tentukan titik beku larutan itu Kf air = 1,86 oC/m
PEMBAHASAN :
Mencari molalitas urea
![]()
![]()
Mencari molalitas NaCl
![]()
![]()
Mencari molalitas CaCl2
![]()
![]()
ΔTf = Kf.mtotal
ΔTf = 1,86. (1 + 0,2 . 2 + 0,1 . 3)
ΔTf = 3,162
Tfo-Tfl = 3,162
Tfl= 0 − 3,162 = -3,162oC
Soal No.31
Suatu larutan garam dapur pada suhu toC, tekanan uap jenuhnya 0,4 mmHg lebih rendah dari tekanan uap jenuh air murni. Jika tekanan uap jenuh air pada suhu tersebut adalah 24 mmHg berapa % berat NaCl dalam larutan tersebut?
PEMBAHASAN :
diketahui ΔP = 0,4 mmHg
Po = 24 mmHg, mencari nilai xt terlebih dahulu
ΔP = Po . xt
![]()
![]()
(Rumus diambil dari Textbook McMurry Chemistry, 4th. Halaman 446)
karena nilai i = 2 (jumlah ion NaCl = 2), maka nilai nt dan np dapat langsung dicari dari xt
nt.i = 1 mol
![]()
np = 60-1 = 59 mol
Gr air = n x Mr = 59 x 18 = 1062 gram
![]()
![]()
Soal No.32
Sebanyak 2,4 gram magnesium sulfat dilarutkan ke dalam 400 gram air. Larutan ini mendidih pada suhu 100,0468 oC. Jika diketahui Kb air = 0,52 oC/m dan Kf air = 1,86 oC/m, tentukan derajat ionisasi magnesium dan titik beku larutan tersebut.
PEMBAHASAN :
ΔTb = 100,0468 − 100 = 0,0468 oC
Mr MgSO4 = 120
jumlah ion (n) MgSO4 = 2
menentukan derajat ionisasi (α) Magnesium Sufat
ΔTb = Kb.m.i
![]()
![]()
1,8 = (1 + α)
α = 1,8 – 1 = 0,8
Menentukan titik beku larutan
Dicari melalui perbandingan dengan ΔTb
![]()
Karena nilai m dan i nya sama maka:
![]()
![]()
ΔTf = Tfo − Tfl
0,167 = 0 − Tfl
Tfl = -0,167oC
Soal No.33
Sebanyak 1,17 gram NaCl dilarutkan dalam air hingga volumenya 400 mL. Berapakah tekanan osmotik larutan ini jika diukur pada keadaan di mana volume 16 gram gas metana pada tekanan 80 cmHg adalah 20 liter.
PEMBAHASAN :
Metana = CH4, Mr = 16
Mr NaCl = 58,5
i NaCl = 2
untuk menentukan tekanan osmosis NaCl kita cari melalui perbandingan
![]()
Karena R dan T nya sama maka
![]()
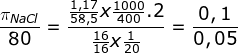
![]()
Soal No.34
Larutan yang mengandung 8 gram NaOH dalam 500 gram air ditambahkan ke dalam 3,65 gram HCl dalam 1000 gram air. Diketahui Kf air = 1,86 oC/m. Setelah kedua larutan dicampur dan diaduk, pada suhu berapakah campuran tersebut akan membeku
PEMBAHASAN :
Mr NaOH = 40
Mr HCl = 36,5
i NaOH = 2
i HCl = 2
Mencari Titik beku campuran NaOH dan HCl
ΔTf = Kf.(m.i)total
ΔTf = 1,86.(mNaOH.i+mHCl.i)
![]()
ΔTf = 1,86.(0,8 + 0,2) = 1,86
ΔTf = Tfo − Tfl
1,86 = 0 − Tfl
Tfl = − 1,86 oC
Soal No.35
Sebanyak 10 gram logam natrium dimasukkan ke dalam 100 mL air. Kf air = 1,86 oC/m. Jika tekanan udara 1 atm, pada suhu berapakah larutan yang diperoleh akan membeku? Berapa liter gas dalam keadaan standar yang dihasilkan
PEMBAHASAN :
Reaksi yang terjadi jika Logam Na Dimasukan ke dalam air
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Ar Na = 23,
![]()
mol Na = mol NaOH = 0,43
i NaOH = 2
Menentukan titik beku NaOH
ΔTf = Kf.m.i
![]()
ΔTf = 15,996
ΔTf = Tfo − Tfl
15,996 = 0 − Tfl
Tfl = − 15,996 oC
menentukan volume H2 (keadaan standar)
mol H2 = 1/2 x 0,43 = 0,215 mol
pada keadaan standar berlaku:
V = n x 22,4L
V = 0,215 x 22,4 L
V = 4,816 L
Soal No.36
Berapa gram kristal H2C2O4.2H2O yang harus dilarutkan ke dalam air agar di dapatkan 600 ml larutan H2C2O4.2H2O 0,5 M (Ar C = 12, O = 16, H = 1)
PEMBAHASAN :
Mr H2C2O4.2H2O = Ar H x 2 + Ar C x 2 + Ar O x 4 + Ar H x 4 + Ar O x 2 = 1×2 + 12×2 + 16×4 + 1×4 + 16×2 = 126
![]()
![]()
![]()
Soal No.37
Di dalam 400 mL larutan amonia, terlarut 3,4 gram NH3 (Ar N = 14, H = 1). Hitunglah:
- molaritas larutan
- fraksi mol
PEMBAHASAN :


- misalkan ρ larutan = 1 gr/cm3
massa larutan = ρ.V = 1 gr/cm3 . 400 mL = 400 gr
massa air = (400-3,4)gr = 396,6 gr



Soal No.38
Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40% (Mr NaOH = 40)
PEMBAHASAN :
Menentukan molalitas
![]()
Menentukan Fraksi Mol
Misal 100 % = 100 gram, maka:
massa NaOH = 40 gram
massa air = 60 gram
![]()
![]()
![]()
Soal No.39
Jika perubahan volume dalam pelarutan diabaikan, tentukan molaritas dan molalitas larutan yang terjadi jika 100 mL alkohol dicampurkan dengan 200 mL air (massa jenis alkohol dan air dianggap sama dengan 1 gram/mL)
PEMBAHASAN :
Menentukan molaritas
massa alkohol m = ρ.V=1.100 = 100 gram
massa air m = ρ.V=1.200 = 200 gram
Jika dimisalkan alkoholnya adalah Etanol (C2H5OH), maka Mrnya = 46
Karena volume pelarutan diabaikan maka volume larutan = 200 mL
![]()
Menentukan molalitas
![]()
Soal No.40
Berapa gram KOH yang harus dilarutkan ke dalam 400 mL air agar didapatkan larutan KOH 0,2 M? (Ar K = 39, O = 16, H = 1)
PEMBAHASAN :
![]()
![]()
![]()
Soal No.41
Suatu larutan manitol yang mengandung 18,04 gram manitol dalam 100 gram air pada suhu 20oC mempunyai tekanan uap 17,23 mmHg. Jika tekanan uap jenuh air pada suhu tersebut adalah 17,54 mmHg; hitunglah massa molekul relatif manitol
PEMBAHASAN :
Po=17,54 mmHg
Pl = 17,23 mmHg
![]()
Untuk menentukan Mr menggunakan rumus:
![]()
Soal No.42
Berapa mmHg tekanan uap larutan sukrosa 2 m pada suhu 20 oC, jika diketahui tekanan uap air murni pada suhu tersebut adalah 17,40 mmHg dan Mr air = 18?
PEMBAHASAN :
2 molal dapat diartikan 2 mol sukrosa dalam 1 kg air.
![]()
Dari pengertian tersebut dapat ditentukan tekanan uap larutannya
Pl = Po. xp
![]()
Soal No.43
Sebanyak 25 gram ureum yang dilarutkan dalam 525 gram air, pada 20 oC mempunyai tekanan uap 17,29 mmHg. Jika pada suhu tersebut tekanan uap air murni adalah 17,54 mmHg; tentukan Mr ureum tersebut
PEMBAHASAN :
![]()
Untuk menghitung Mr menggunakan rumus cepat:
![]()
![]()
Soal No.44
Hitung tekanan uap larutan glukosa 36% dalam air pada suhu 25 oC, jika diketahui tekanan uap air murni pada suhu tersebut adalah 20 mmHg.
PEMBAHASAN :
misal 100% larutan = 100 gram
massa 36% glukosa = 36 gram
Mr Glukosa = 180
massa air = 100-36 gram = 64 gram
Mr air = 18
![]()
![]()
Menentukan Pl
Pl = Po.xp
![]()
Soal No.45
Sebanyak 9 gram glukosa dilarutkan dalam 900 gram air. Jika diketahui tekanan uap jenuh pelarut murni pada suhu 20 oC adalah 17,5 mmHg; tentukan penurunan tekanan uap larutan pada suhu tersebut.
PEMBAHASAN :
Mr Glukosa = 180
Mr air = 18
![]()
![]()
ΔP = Po.xt
![]()
Soal No.46
Diketahui tekanan uap air pada suhu 30 oC adalah 31,84 mmHg. Untuk mendapatkan larutan yang tekanan uap jenuhnya 27,86 mmHg pada suhu tersebut; berapa massa glikol (Mr = 62) yang harus dilarutkan dalam 630 gram air?
PEMBAHASAN :
![]()
Untuk menentukan massa glikol menggunakan rumus:
![]()
Soal No.47
Ke dalam 100 ml air dilarutkan 20 gram urea (Mr = 60). Hitung berapa kadar larutan urea ke dalam satuan persen (%) dan satuan molalitas (m)
PEMBAHASAN :
Diketahui:
Gr Urea = 20 gram
Mr Urea = 60
Gr air = ρ. V = 1 gr/mL. 100 mL = 100 gram
Menentukan kadar urea dalam persen
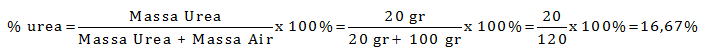
Menentukan molalitas
![]()
Soal No.48
Berapa gram kristal MgSO4.7H2O yang harus dilarutkan ke dalam air agar diperoleh 100 mL larutan MgSO4 0,2 M? (Ar Mg = 24, S = 32, O = 16, dan H = 1)
PEMBAHASAN :
Diketahui:
M = 0,2 M
V = 100 mL
Mr MgSO4.7H2O = 24 x 1 + 32 x 1 + 16 x 4 + 1 x 14 + 16 x 7 = 246
Menentukan Gram gram kristal MgSO4.7H2O
Karena mengandung hidrat (air) maka mr dihitung dengan jumlah hidratnya
![]()
![]()
![]()
Soal No.49
Hitung molalitas dan fraksi mol larutan KOH dalam air yang kadarnya 28% (Mr KOH = 56)
PEMBAHASAN :
Diketahui:
% KOH = 28%
Mr KOH = 56
Misalkan massa larutan = 100 gram
maka massa KOH = 28 % x 100 gram = 28 gram
Massa air = 100 gr − 28 gr = 72 gram
Menentukan molalitas menggunakan cara biasa
![]()
Menentukan molalitas menggunakan rumus cepat
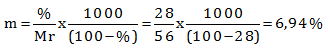
Menentukan fraksi mol
![]()
![]()
![]()
Soal No.50
Berapa gram glukosa (C6H12O6) yang terlarut di dalam larutan glukosa 0,2 M? (Ar C = 12, H = 1, dan O = 16)
PEMBAHASAN :
Diketahui:
M = 0,2 M
Mr = 12 x 6 + 1 x 12 + 16 x 6 = 180
V larutan = 1 Liter (0,2 M artinya 0,2 mol zat terlarut dalam 1 liter larutan)
Menentukan massa glukosa
![]()
![]()
Gr = 0,2 x 180 = 36 gram
Soal No.51
Berapa gram NH4Cl yang harus dilarutkan ke dalam 400 mL air agar diperoleh larutan NH4Cl 1 m? (Ar N = 14; Cl = 35,5; dan H = 1)
PEMBAHASAN :
Diketahui:
V air = 400 mL
maka massa air = ρ. V = 1 gr/ml. 400 mL = 400 gr
m = 1 m
Mr NH4Cl = 14×1 + 1×4 + 35,5×1 = 53,5
Menentukan massa NH4Cl
![]()
![]()
![]()
Soal No.52
Berapa mmHg tekanan uap larutan sukrosa 4 m pada suhu 25oC jika diketahui tekanan uap air murni pada suhu tersebut adalah 34,80 mmHg, serta Mr air = 18 dan sukrosa = 342?
PEMBAHASAN :
Diketahui:
m = 4 m
Po = 34,80 mmHg
Mr air = 18
Mr sukrosa = 342
Menentukan tekanan uap larutan sukrosa
molalitas 4 m artinya mol sukrosa = 4 mol dalam 1 kg air, maka mol air = Gr/Mr = 1000 gr/18 = 55,56 mol
P = Po. xp
![]()
Soal No.53
Hitung tekanan uap larutan glukosa 72% dalam air pada suhu 25oC, jika diketahui tekanan uap air murni pada suhu tersebut adalah 40 mmHg (Mr glukosa = 180)
PEMBAHASAN :
Diketahui:
% glukosa = 72%
Po = 40 mmHg
Mr glukosa = 180
Menentukan tekanan uap larutan glukosa
Jika dimisalkan massa larutan = 100 gram, maka massa glukosa = 72% x 100 gram = 72 gram
massa air = 100 − 72 = 28 gram
![]()
![]()
P = Po. xp
![]()
Soal No.54
Sebanyak 9 gram glukosa dilarutkan dalam 180 mL air. Jika diketahui tekanan uap jenuh air pada suhu 20oC adalah 17,5 mmHg; hitung tekanan uap larutan pada suhu tersebut
PEMBAHASAN :
Diketahui:
Gr glukosa = 9 gram, maka mol glukosa
![]()
V air = 180 ml maka massa air = ρ. V = 1 gr/ml . 180 ml = 180 gram
![]()
Po = 17,5 mmHg
Menentukan tekanan uap larutan gukosa
P = Po. xp
![]()
Soal No.55
Suatu larutan manitol yang mengandung 492,06 gram manitol dalam 50 gram air pada suhu 25oC mempunyai tekanan uap 8,77 mmHg. Jika tekanan uap jenuh air pada suhu tersebut adalah 17,54 mmHg; hitung massa molekul relatif manitol.
PEMBAHASAN :
Diketahui:
Gr manitol = 492,06 gram
Gr air = 50 gram
P = 8,77 mmHg
Po = 17,54 mmHg
Menentukan Mr manitol
![]()
P = Po. xp
![]()
8,77 (2,78 + nt) = 17,54. 2,78
24,38 + 8,77nt = 48,76
8,77nt = 48,76 − 24,38 = 24,38
![]()
![]()
Soal No.56
Sukrosa (C12H22O11) dilarutkan dalam 360 gram air. Tekanan uap larutan tersebut terukur sebesar 21,5 mmHg. Hitung massa sukrosa yang dilarutkan jika diketahui tekanan uap jenuh air murni pada suhu 25oC adalah 23,8 mmHg
PEMBAHASAN :
Diketahui:
Gr sukrosa = 360 gram
Mr sukrosa = 342
P = 21,5 mmHg
Po = 23,8 mmHg
![]()
Menentukan massa sukrosa
P = Po. xp
![]()
21,5(20 + nt) = 23,8. 20
430 + 21,5nt = 476
21,5 nt = 476 − 430 = 46
![]()
Gr = nt x Mr = 2,139 mol x 342 = 731,538 gram
Soal No.57
Larutan fruktosa sering ditambahkan pada makanan sebagai pemanis makanan. Sebanyak 360 gram sirop fruktosa dilarutkan dalam sebuah bejana berisi air pada suhu 20oC. Hitung jumlah air pada bejana tersebut agar terjadi penurunan tekanan uap larutan sebesar 3 mmHg. (tekanan uap jenuh air murni pada suhu 20oC = 18 mmHg dan Mr fruktosa = 180)
PEMBAHASAN :
Gr fruktosa = 360 gram
ΔP = 3 mmHg
Po = 18 mmHg
Mr fruktosa = 180
![]()
Mr air = 18
Menentukan massa air yang diperlukan
ΔP = Po. xt
![]()
![]()
3(2 + np) = 36
6 + 3np = 36
3np = 36 − 6 = 30
np = 10
Gr = n x Mr = 10 mol x 18 = 180 gram
Soal No.58
Sebanyak 364 gram kristal sorbitol ditambahkan dalam sejumlah air. Jika air yang terdapat pada bejana sebesar 2,88 L; hitung tekanan uap larutan jika diketahui tekanan uap jenuh air murni sebesar 20 mmHg (Mr sorbitol = 158)
PEMBAHASAN :
Gr sorbitol = 364 gram
V air = 2,88 L
maka massa air = ρ. V = 1 Kg. 2,88 L = 2,88 Kg = 2880 gram
Mr sorbitol = 158
![]()
![]()
Po = 20 mmHg
Menentukan tekanan uap larutan sorbitol
P = Po. xp
![]()
Soal No.59
Sebanyak 240 gram kristal X dilarutkan dalam 252 mL air (Mr = 18). Jika diketahui tekanan uap jenuh larutan adalah 14 mmHg, tentukan massa molekul relatif zat X tersebut jika tekanan uap jenuh air murni pada suhu yang sama adalah 18 mmHg.
PEMBAHASAN :
Gr X = 240 gram
V air = 252 mL, maka massa air = ρ. V = 1 gr/ml . 252 ml = 252 gram
![]()
P = 14 mmHg
Po = 18 mmHg
P = Po. xp
![]()
![]()
14(14 + nt) = 18. 14
196 + 14nt = 252
14nt = 252 − 196 = 56
nt = 4
![]()
![]()
Soal No.60
Sebanyak 5 mol cairan toluena dilarutkan dalam larutan benzena sebanyak 10 mol. Hitung tekanan uap jenuh larutan setelah penambahan toluena tersebut. (tekanan uap jenuh benzena pada suhu 25oC adalah 30 mmHg)
PEMBAHASAN :
n toluena = 5 mol (zat terlarut)
n benzena = 10 mol (zat pelarut)
Po = 30 mmHg
P = Po. xp
![]()
Soal No.61
Hitung tekanan uap larutan jika 3 mol zat cair volatil (zat yang mudah menguap) dicampurkan dengan 4 mol zat cair nonvolatil. Diketahui tekanan uap jenuh zat cair volatil murni pada suhu tersebut adalah 50 mmHg.
PEMBAHASAN :
mol volatil = 3 mol
mol non volatil = 4 mol
Po = 50 mmHg
zat volatil dianggap sebagai pelarut karena mudah menguap, sedangkan zat non volatil dianggap sebagai zat terlarut
P = Po. xp
![]()
Soal No.62
Pada label sebuah es krim, tertulis bahwa es krim harus disimpan pada suhu -15oC atau kurang agar tetap membeku. Es krim tersebut diketahui mengandung 34,2 gram sirop sukrosa (Mr = 342 gram/mol) dan sejumlah air. Hitung volume air yang digunakan dalam pembuatan es tersebut. (Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
Tf = -15oC
Tfo = 0oC
ΔTf = Tfo − Tf = 0 − (-15) = 15 oC
Gr sukrosa = 34,2 gram
Mr sukrosa = 342
Kf air = 1,86 oC/m
Menentukan volume air yang diperlukan
![]()
![]()
![]()
Maka volume air yang diperlukan
![]()
Soal No.63
Di negara dengan empat musim cairan glikol (Mr = 62) biasanya ditambahkan pada air radiator mobil untuk menghindari pembekuan air radiator selama musim dingin. Hitung berapa massa glikol yang perlu ditambahkan jika volume air radiator adalah 2,5 L. (Kf air = 1,86 oC/m dan perkiraan suhu udara maksimum adalah -7,44 oC)
PEMBAHASAN :
Diketahui:
Mr glikol = 62
Volume air = 2,5 L sehingga massa airnya (P) = ρ. V = 1 kg/L. 2,5 L = 2,5 kg
Kf = 1,86 oC/m
Tf = -7,44 oC
Tfo = 0 oC
ΔTf = Tfo − Tf = 0 − (-7,44) = 7,44 oC
Menentukan massa glikol
![]()
![]()
![]()
Soal No.64
Seorang penjual es keliling menambahkan 180 gram glukosa (C6H12O6) dalam 500 mL air sebagai resep pembuatan minuman esnya. Hitung titik beku minuman es tersebut. (Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui
Gr glukosa = 180 gram
Mr glukosa = 180
V air = 500 mL, maka massa air = ρ. V = 1 gr/ml. 500 mL = 500 gram
Menentukan titik beku minuman es
![]()
![]()
0 − Tf = 3,72
Tf = -3,72 oC
Soal No.65
Sebanyak 180 gram zat nonelektrolit (Mr = 60) dilarutkan dalam air dengan volume 2.500 mL. Hitung titik beku zat tersebut. (Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
Gr zat = 180 gram
V air = 2.500 mL maka massa airnya = ρ. V = 1 gr/mL. 2.500 mL = 2.500 gram
Kf air = 1,86 oC/m
Menentukan titik beku larutan
![]()
ΔTf = Tfo − Tf = 0oC − Tf = 2,232
Tf = -2,232 oC
Soal No.66
Indikator fenolftalein (PP) dilarutkan dalam pelarut etanol (Kf = -2 oC/m) membentuk larutan PP. Tentukan Mr dari indikator PP jika massa zat yang dilarutkan adalah 31,8 gram dan volume etanol yang digunakan sebesar 200 mL. (larutan PP mengalami penurunan titik beku sebesar -1 oC dan ρ etanol = 789 kg/m3)
PEMBAHASAN :
Diketahui:
Kf etanol = -2 oC/m
Gr PP = 31,8 gram
ρ etanol = 789 kg/m3 = 789/1000 kg/dm3 = 0,789 kg/dm3 = 0,789 g/mL
Volume etanol = 200 mL, maka massa etanol = ρ. V = 0,789 g/mL. 200 mL = 157,8 gram
ΔTf = -1 oC/m
Menentukan Mr PP
![]()
![]()
![]()
Soal No.67
Suatu larutan X mendidih pada suhu 102,8 oC. Pada suhu berapakah larutan tersebut akan membeku? (Kb air = 0,52 oC/m dan Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
Tb = 102,8 oC
Kb = 0,52 oC/m
Kf = 1,86 oC/m
Menentukan titik beku larutan melalui perbandingan
![]()
Karena molalitasnya sama maka molalitas dapat dicoret
![]()
![]()
![]()
Tf = -10,015 oC
Soal No.68
Sebanyak 60 gram urea (Mr = 60) dilarutkan dalam 100 mL etanol. Jika titik beku larutan tersebut -116,59 oC (titik beku etanol murni adalah -114,6 oC), berapakah tetapan titik beku molal etanol?
PEMBAHASAN :
Diketahui:
Gr urea = 60 gram
Mr = 60
V etanol = 100 ml, maka massa etanol = ρ. V = 0,789 gr/mL. 100mL = 78,9 gram
Tf = -116,59 oC
Tfo = -114,6 oC
ΔTf = Tfo − Tf = (-114,6) − (-116,59) = 1,99
Menentukan nilai Kf etanol
![]()
![]()
![]()
Soal No.69
Berapa gram urea (Mr = 60) yang harus dilarutkan ke dalam 250 gram air agar larutan yang terjadi membeku pada suhu 0,74 oC di bawah titik beku air? (Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
Mr = 60
P = 250 gram
ΔTf = 0,74 oC
Kf = 1,86 oC/m
Menentukan massa urea
![]()
![]()
![]()
Soal No.70
Suatu zat bermassa 5,3 gram dilarutkan ke dalam 500 gram air. Larutan yang terbentuk dapat membeku pada suhu -0,576 oC. Tentukan Mr zat tersebut jika tetapan penurunan titik beku molal (Kf) air sebesar 1,86 oC/m
PEMBAHASAN :
Diketahui:
Gr zat = 5,3 gram
P = 500 gram
Tf = -0,576 oC
Tfo = 0 oC
ΔTf = Tfo − Tf = 0 − (-0,576) = 0,576 oC
Kf = 1,86 oC/m
Menentukan Mr zat
![]()
![]()
Soal No.71
Suatu larutan dalam air mendidih pada suhu 101,4 oC. Jika diketahui Kf air = 0,52 oC/m dan Kf air = 1,86 oC/m; pada suhu berapakah larutan tersebut akan membeku?
PEMBAHASAN :
Diketahui:
Tb = 101,4 oC
ΔTb = Tb − Tbo = 101,4 − 100 = 1,4 oC
Kb = 0,52 oC/m
Kf = 1,86 oC/m
Menentukan titik beku larutan melalui perbandingan
![]()
Karena molalitasnya sama maka molalitas dapat dicoret
![]()
![]()
![]()
Tf = − 5 oC
Soal No.72
Glukosa (C6H12O6) yang massanya 18 gram dilarutkan ke dalam 200 mL air. Berapa titik didih larutan yang terbentuk jika diketahui Kb air = 0,52 oC/m dan pada tempat tersebut air murni mendidih pada suhu 98 oC? (Ar C = 12, H = 1, dan O = 16)
PEMBAHASAN :
Diketahui:
Massa glukosa = 18 gram
V air = 200 mL, maka massa air = ρ. V = 1 gr/mL . 200 mL = 200 gram
Kb air = 0,52 oC/m
Tbo = 98 oC
Mr glukosa = 12 x 6 + 1 x 12 + 16 x 6 = 180
Menentukan Tb
ΔTb = Kb.m
![]()
![]()
Tb − 98 = 0,26
Tb = 98 + 0,26 = 98,26 oC
Soal No.73
Di pegunungan, air mendidih pada suhu sekitar 96 oC. Jika 3,42 gram sukrosa dilarutkan dalam 100 mL air yang mendidih, berapakah titik didih larutan sukrosa tersebut? (Kb air = 0,52 oC/m)
PEMBAHASAN :
Diketahui
Tbo = 96 oC
Gram sukrosa = 3,42 gram, Mr sukrosa = 342
V air = 100 ml, maka massa air = ρ. V = 1 gr/ml. 100 ml = 100 gram
Kb air = 0,52 oC/m
Menentukan Tb larutan sukrosa
ΔTb = Kb.m
![]()
![]()
Tb − 96 = 0,052
Tb = 96 + 0,052 = 96,052 oC
Soal No.74
Sebanyak 60 gram kristal nonelektrolit X dilarutkan dalam 2.000 mL air. Jika titik didih yang terukur dari larutan X tersebut adalah 100,26 oC; berapakah massa molekul relatif senyawa X tersebut?
PEMBAHASAN :
Diketahui:
Gr kristal X = 60 gram
V air = 2.000 mL, maka massa air = ρ. V = 1 gr/mL. 2.000 mL = 2.000 gram
Tb = 100,26 oC
Menentukan Mr zat X
ΔTb = Kb.m
![]()
![]()
![]()
Soal No.75
Kristal naftalena memiliki rumus empiris C5H4. Sejumlah 512 gram kristal tersebut dilarutkan dalam 2.000 mL pelarut benzena dan dipanaskan hingga mendidih pada suhu 85,3 oC. Berapakah Mr dari senyawa naftalena tersebut? (Kb benzena = 2,65 oC/m, titik didih benzena = 80 oC, dan ρ benzena = 876 kg/m3)
PEMBAHASAN :
Diketahui:
Rumus empiris naftalena = C5H4
Gram naftalena = 512 gram
ρ benzena = 876 kg/m3 = 0,876 kg/dm3 = 0,876 gr/mL
V benzena, maka massa benzena (P) = ρ. V = 0,876 gr/mL. 2.000 mL = 1752 gram
Kb benzena = 2,65 oC/m
Tb = 85,3 oC
Tbo = 80 oC
ΔTb = Tb − Tbo = 85,3 − 80 = 5,3 oC
Menentukan Mr senyawa naftalena
ΔTb = Kb. m
![]()
![]()
![]()
Soal No.76
Sejumlah zat dilarutkan dalam 250 mL air sehingga titik didih larutan tersebut menjadi 102 oC. Jika Kb air adalah 0,52 oC/m, tentukan berapa gram zat yang dilarutkan dalam air. (Mr zat = 60)
PEMBAHASAN :
Diketahui:
V air = 250 mL, maka massa air ( P) = ρ. V = 1 gr/mL. 250 mL = 250 gram
Tb = 102 oC
Tbo = 100 oC
ΔTb = Tb − Tbo = 102 − 100 = 2 oC
Kb = 0,52 oC/m
Mr zat = 60
Menentukan massa zat
ΔTb = Kb. m
![]()
![]()
![]()
Soal No.77
Sejumlah zat X (Mr = 128) dilarutkan dalam pelarut karbon tetraklorida yang memiliki titik didih murni sebesar 76,8 oC. Jika massa zat x yang terlarut sebanyak 25,6 gram dan volume pelarut 250 mL, hitung kenaikan titik didih larutan tersebut. (Kb CCl4 = 4,88 oC/m) dan ρ CCl4 = 1,59 g/cm3)
PEMBAHASAN :
Diketahui:
Tbo = 76,8 oC
Mr zat = 128
massa zat x = 25,6 gram
Volume pelarut = 250 mL, maka massa pelarut (P) = ρ. V = 1,59 g/mL. 250 mL = 397,5 gram
Kb CCl4 = 4,88 oC/m
Menentukan kenaikan titik didih
ΔTb = Kb. m
![]()
Soal No.78
Pelarut benzena digunakan untuk melarutkan senyawa organik yang tidak diketahui massanya. Jika Mr senyawa organik tersebut adalah 180 dan volume benzena sebesar 500 mL, hitung massa senyawa organik yang dilarutkan tersebut jika kenaikan titik didihnya sebesar 0,5 oC (Kb benzena 2,65 oC/m dan titik didih benzena 80 oC)
PEMBAHASAN :
Diketahui:
Mr = 180
ρ benzena = 876 kg/m3 = 0,876 g/mL
Volume benzena = 500 mL, maka massa benzena = ρ. V = 0,876 g/mL. 500 mL = 438 gram
ΔTb = 0,5 oC
Kb benzena =2,65 oC/m
Menentukan massa senyawa organik
ΔTb = Kb. m
![]()
![]()
![]()
Soal No.79
Hitung molalitas zat X jika dalam jumlah pelarut yang sama, kenaikan titik didih larutan urea 0,2 m adalah 0,60 oC dan kenaikan titik didih larutan X adalah 0,4 oC
PEMBAHASAN :
Diketahui:
ΔTb urea = 0,60 oC
m urea = 0,2 m
ΔTb zat X = 0,4 oC
Menentukan molalitas zat X dengan cara perbandingan dengan urea
![]()
Kb dapat dicoret karena pelarutnya sama
![]()
![]()
Soal No.80
Gula dapat larut dalam air maupun dalam pelarut organik lainnya. Jika dengan massa yang sama, larutan gula dimasukkan ke dalam 100 mL air (Kb = 0,52 oC/m) dan 100 mL pelarut organik (Kb = 2 oC/m), larutan manakah yang akan memiliki kenaikan titik didih lebih besar? Jelaskan
PEMBAHASAN :
Rumus kenaikan titik didih
ΔTb = Kb. m
Yang membedakan adalah nilai Kb, sedangkan nilai lainnya sama. Maka yang dilihat adalah hubungan ΔTb dengan Kb. Karena ΔTb sebanding dengan Kb maka jika Kb nya lebih besar ΔTb nya juga akan lebih besar. Sehingga gula akan memiliki kenaikan titik didih yang lebih besar jika dilarutkan pada pelarut organik karena memiki Kb yang lebih besar. Sedangkan kenaikan titik didih akan lebih kecil jika dilarutkan pada air karena nilai Kbnya lebi kecil.
Soal No.81
Untuk menentukan massa rumus suatu zat; diambil 0,45 gram zat tersebut, kemudian dilarutkan ke dalam 30 gram air. Larutan tersebut mendidih pada suhu 100,26 oC. Jika tetapan kenaikan titik didih molal (Kb) air adalah 0,52 oC/m, tentukan massa molekul relatif zat tersebut
PEMBAHASAN :
Diketahui:
Gr zat terlarut = 0,45 gram
P = 30 gram
Tb = 100,26 oC
Kb = 0,52 oC
Menentukan Mr zat terlarut
ΔTb = Kb.m
![]()
![]()
![]()
Soal No.82
Sebanyak 6,84 gram sukrosa (Mr = 342) dilarutkan dalam air hingga volumenya 500 mL. Hitung tekanan osmotik larutan tersebut pada suhu 27 oC
PEMBAHASAN :
Diketahui:
Gr sukrosa = 6,84 gram
Mr sukrosa = 342
V larutan = 500 mL
T = 27 oC + 273 = 300 K
Menentukan tekanan osmotik
π = M. R. T
![]()
Soal No.83
Sebanyak 3,2 gram naftalena (Mr = 128) dilarutkan ke dalam benzena hingga volumenya 250 mL. Hitung tekanan osmotik yang terjadi pada suhu 27 oC
PEMBAHASAN :
Diketahui:
Gr Naftalena = 3,2 gram
Mr = 128
V = 250 mL
T = 27 oC + 273 = 300 K
Menentukan tekanan osmotik
π = M. R. T
![]()
Soal No.84
Tekanan osmotik larutan yang mengandung 50 gram suatu karbohidrat per liter pada 0 oC adalah 6,2 atm. Hitung massa rumus karbohidrat tersebut.
PEMBAHASAN :
Diketahui:
π = 6,2 atm
Gr karbohidrat = 50 gram
T = 0 oC + 273 = 273 K
V = 1 liter
Menentukan Mr zat
π = M. R. T
![]()
![]()
Soal No.85
Suatu larutan nonelektrolit isotonis dengan larutan elektrolit. Jika larutan nonelektrolit tersebut mempunyai konsentrasi 0,5 M dan tekanan osmotik 2 atm, hitung tekanan osmotik larutan elektrolit biner yang mempunyai konsentrasi 0,2 M
PEMBAHASAN :
Isotonis yaitu dua larutan yang memiliki tekanan osmosis yang sama
π1 = π2
Maka tekanan osmotik larutan elektrolit = 2 atm
Soal No.86
Untuk menentukan massa molekul suatu polimer, sebanyak 15 gram polimer dilarutkan ke dalam 1 liter air. Pada 300 K, larutan ini mempunyai tekanan osmotik 1,1 atm. Tentukan massa molekul polimer tersebut
PEMBAHASAN :
Diketahui:
Gr polimer = 15 gr
V larutan = 1 L
T = 300 K
π = 1,1 atm
Menentukan Mr polimer
π = M. R. T
![]()
![]()
Soal No.87
Ke dalam 400 gram air dilarutkan 0,02 mol Na2SO4 pada suhu 20 oC. Jika pada suhu tersebut tekanan uap air murni adalah 17,4 mmHg; hitung tekanan uap larutan tersebut
PEMBAHASAN :
Diketahui:
Gram air = 400 gram, maka ![]()
n Na2SO4 = 0,02 mol
Na2SO4 termasuk elektrolit kuat, maka i = n = 3 (ion 2Na+ dan ion SO42-)
Po = 17,4 mmHg
Menentukan tekanan uap larutan Na2SO4
P = Po. xp
![]()
(Rumus diambil dari Textbook McMurry Chemistry, 4th. Halaman 446)
![]()
Soal No.88
Tentukan titik beku larutan 48 gram MgSO4 dalam 100 gram air jika Kf air = 1,86 oC/m dan dianggap bahwa zat terlarut terionisasi sempurna. (Ar Mg = 24, S = 32, dan O = 16)
PEMBAHASAN :
Diketahui:
Gr MgSO4 = 48 gram
P = 100 gram
Mr MgSO4 = 24 x 1 + 32 x 1 + 16 x 4 = 120
n MgSO4 = 2 (diperoleh dari ionisasi MgSO4, menghasilkan 2 ion yaitu Mg2+ dan SO42-)
Terionisasi sempurna (elektrolit kuat), maka i = n = 2
Kf = 1,86 oC/m
Menentukan titik beku larutan MgSO4
ΔTf = Kf. m. i
![]()
ΔTf = Tfo − Tf
14,88 = 0 − Tf
Tf = -14,88
Soal No.89
Sebanyak 4,4 gram CaSO4 yang dilarutkan ke dalam air hingga volumenya 100 mL terurai sempurna. Hitung tekanan osmotik dari larutan yang terjadi pada suhu 27 oC (Ar Ca = 40, S = 32, dan O = 16)
PEMBAHASAN :
Diketahui:
Gr CaSO4 = 4,4 gram
Mr CaSO4 = 40 x 1 + 32 x 1 + 16 x 4 = 136
V = 100 mL
T = 27 oC + 273 = 300 K
i = n = 2 (elektrolit kuat, Ca2+ dan SO42-)
π = M. R.T.i
![]()
Soal No.90
Sebanyak 2 mol CH3COOH dilarutkan sampai volumenya 500 mL dengan derajat ionisasi 60%. Tentukan titik didih dan titik beku larutan . (Kb air = 0,52 oC/m dan Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
V = 500 mL
n CH3COOH = 2 mol
α = 60 % =0,6
i CH3COOH = ( 1 + (n-1)α) = (1 + (2-1)0,6) = 1,6
Menentukan titik didih
ΔTb = Kb.m.i
![]()
ΔTb = Tb − Tbo = Tb − 100 = 3,328
Tb = 100 + 3,328 = 103,328 oC
Menentukan titik beku
ΔTf = Kf.m.i
![]()
ΔTf = Tfo − Tf = 0 − Tf = 11,9 oC
Tf = 0 − 11,9 = -11,9 oC
Soal No.91
Berapa gram K2SO4 yang harus dilarutkan ke dalam 10 liter air agar larutan yang terbentuk mendidih pada suhu 106 oC (tekanan 1 atm)? (Kb air = 0,52 oC/m; Ar K = 39, S = 32, dan O = 16)
PEMBAHASAN :
Diketahui:
Mr K2SO4 = 39 x 2 + 32 x 1 + 16 x 4 = 174
V air = 10 liter, maka massa air (P) = ρ. V = 1 Kg/L . 10 L = 10 Kg
Tb = 106 oC
Tbo = 100 oC
ΔTb = Tb − Tbo = 106 − 100 = 6 oC
K2SO4 merupakan elektrolit kuat, maka i = n = 3 (2 ion K+ dan 1 ion SO42-)
Menentukan massa K2SO4
ΔTb = Kb. m. i
![]()
![]()
![]()
Soal No.92
Larutan H2S 1 M isotonis dengan larutan urea 2 M pada suhu yang sama. Tentukan persen volume larutan H2S yang terionisasi dalam larutan
PEMBAHASAN :
Diketahui:
M H2S = 1 M (elektrolit lemah)
M Urea = 2 M (non elektrolit)
Menentukan α H2S
Isotonis yaitu jika dua larutan memiliki tekanan osmosis sama
π urea = π H2S
M. R. T = M. R. T. i (R dan T dapat di coret karena sama)
2 = 1. i
i = 2 = (1 + (n − 1)α) = (1 + (3-1)α) = 1 + 2α
2 = 1 + 2α
2α = 1
α = ½ x 100 % = 50%
Soal No.93
Jika larutan urea mendidih pada suhu 115 oC (tekanan 1 atm), pada suhu berapa larutan MgCl2 dengan konsentrasi yang sama akan mendidih? (Ar Mg = 24 dan Cl = 35,5)
PEMBAHASAN :
Diketahui:
Tb urea = 115 oC
M urea = M MgCl2
urea non elektrolit
MgCl2 Elektrolit kuat sehingga i = n = 3 (1 Mg2+ dan 2 Cl−)
Menentukan Tb MgCl2 melalui perbandingan
![]()
Kb dan m dapat dicoret karena nilainya sama
![]()
ΔTb MgCl2 = 15 x 3 = 45
ΔTb = Tb − Tbo = Tb − 100 = 45
Tb = 100 + 45 = 145 oC
Soal No.94
Larutan HCN 0,18 m membeku pada suhu yang sama dengan larutan glukosa 0,2 m. Hitung derajat ionisasi HCN dalam larutan tersebut.
PEMBAHASAN :
Diketahui:
m HCN = 0,18 m (elektrolit)
m glukosa = 0,2 m (non elektrolit)
Tf HCN = Tf glukosa, maka ΔTf HCN = ΔTf glukosa
n HCN = 2 (1 ion H+ dan 1 CN–)
Menentukan α HCN
ΔTf HCN = ΔTf glukosa
Kf. m. i = Kf. m (Kf bisa dicoret karena pelarutnya sama)
0,18. (1 + (n-1)α) = 0,2
0,18.(1 + (2-1)α) = 0,2
0,18.(1 + α) = 0,2
0,18 + 0,18 α = 0,2
0,18α = 0,2 − 0,18 = 0,02
![]()
Soal No.95
Larutan H2S 1 m membeku pada suhu -2,4 oC. Jika Kf air = 1,86 oC/m, hitung derajat ionisasinya
PEMBAHASAN :
m H2S = 1 m
Tf H2S = -2,4 oC
Kf = 1,86 oC/m
Karena H2S elektrolit maka perlu dikali i dengan n = 2 (1 ion H+ dan 1 ion CN–)
ΔTf = Kf. m. i
Tfo − Tf = 1,86. 1. (1 + (2 − 1)α)
0 − (−2,4) = 1,86(1 + α)
2,4 = 1,86 + 1,86α
1,86α = 2,4 − 1,86 = 0,54
α = 0,54/1,86 =0,29
Soal No.96
Diketahui titik didih larutan urea 0,4 molal adalah 100,208 oC. Jika BaCl2 terionisasi sempurna, hitung titik didih larutan BaCl2 0,1 m.
PEMBAHASAN :
Diketahui:
m urea = 0,4 molal (non elektrolit)
Tb urea = 100,208 oC
m BaCl2 = 0,1 m (elektrolit kuat dengan i = n = 3 (1 ion Ba2+ dan 2 ion Cl−)
Menentukan Tb BaCl2 lewat perbandingan
![]()
Kb dapat dicoret karena pelarutnya sama
![]()
![]()
ΔTb = Tb − Tbo = 0,156
Tb = Tbo + 0,156 = 100 + 0,156 = 100,156 oC
Soal No.97
Hitung titik beku larutan HCl 2 molal yang terionisasi 80% (Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui:
m HCl = 2 molal
n = 2 (1 ion H+ dan 1 ion Cl−)
α = 80 % = 0,8
i = (1 + (n − 1)α) = (1 + (2-1)0,8) = 1,8
Kf = 1,86 oC/m
Menentukan titik beku HCl
ΔTf = Kf.m.i
ΔTf = 1,86. 2. 1,8 = 6, 696
Tfo − Tf = 6, 696
0 − Tf = 6, 696
Tf = -6, 696 oC
Soal No.98
Tekanan osmotik larutan KCl 0,2 M pada suhu 27 oC adalah 5 atm. Hitung derajat ionisasi larutan tersebut.
PEMBAHASAN :
Diketahui:
M = 0,2 M (nilainya akan sama dengan molalitas jika nilainya kecil)
π = 5 atm
T = 27 oC + 273 = 300 K
n KCl = 2 (1 ion K+ 1 ion Cl−)
Menentukan α
π = M. R.T.i
5 = 0,2. 0,082.300.(1 +(n-1)α)
5 = 4,92 (1 +(2-1)α)
5/4,92 = (1 + α)
1,016 = 1 + α
α = 1,016 − 1 = 0,016
Soal No.99
Berapa gram NaCl (Mr = 58,5) yang harus dilarutkan ke dalam 200 mL air agar larutan tersebut membeku pada suhu yang sama dengan larutan yang terbentuk dari 20 gram urea (Mr = 60) dalam 100 mL air?
PEMBAHASAN :
Dketahui:
Mr NaCl = 58,5 (elektrolit kuat, maka i = n = 2 (1 ion Na+ dan 1 ion Cl−))
V air larutan NaCl = 200 mL, maka massa air (P) = ρ. V = 1 gr/mL. 200 mL = 200 gram
Gr urea = 20 gram
V air larutan urea = 100 mL, maka massa air (P) = ρ. V = 1 gr/mL. 100 mL = 100 gram
Tf NaCl = Tf urea, maka ΔTf NaCl = ΔTf urea
ΔTf NaCl = ΔTf urea
Kf. m. i = Kf. m.
Kf dapat dicoret karena pelarutnya sama
![]()
![]()
![]()
Soal No.100
Larutan urea 0,3 M isotonis dengan larutan HCN 0,2 M. Hitung derajat ionisasi asam sianida tersebut.
PEMBAHASAN :
Diketahui:
M urea = 0,3 M
M HCN = 0,2 M (elektrolit dengan n = 2 (1 ion H+ dan 1 ion CN−)
Isotonis yaitu dua larutan memiliki tekanan osmosis yang sama
π urea = π HCN
M.R.T = M.R.T.i
Karena RT nya tetap dapat dicoret
0,3 = 0,2 (1 + (n-1)α)
0,3/0,2 = 1 + (2-1)α
1,5 = 1 + α
α = 1,5 − 1 = 0,5
Soal No.101
Larutan urea 1 m dicampur dengan volume yang sama dengan larutan NaCl 1 m. Hitung titik didih dan titik beku larutan hasil pencampuran tersebut. (Kb air = 0,52 oC/m dan Kf air = 1,86 oC/m)
PEMBAHASAN :
Diketahui :
m urea = 1 m (non elektrolit)
m NaCl = 1 m (elektrolit dengan i = n = 2 (1 ion Na+ dan 1 ion Cl−)
Menentukan titik didih campuran
ΔTb = Kb. (m urea + mNaCl.i)
ΔTb = 0,52. (1 + 1 x 2) = 1,56
ΔTb = Tb − Tbo = 1,56
Tb − 100 = 1,56
Tb = 100 + 1,56 = 101,56
Menentukan titik beku campuran
ΔTf = Kf. (m urea + mNaCl.i)
ΔTf = 1,86. (1 + 1 x 2) = 5,58
ΔTf = Tfo − Tf = 5,58
0 − Tf = 5,58
Tf = 0 − 5,58 = -5,58 oC
Soal No.102
Sebanyak 12 gram kristal MgSO4 dilarutkan dalam air hingga volumenya 500mL. berapa konsentrasi molar (Molaritas) larutan yang terjadi (Ar Mg=24;S=32;O=16)
PEMBAHASAN :
Diketahui: Gr = 12 gr
V = 500 mL
Mr MgSO4 = Ar Mg x 1 + Ar S x 1 + Ar O x 4 = 24 x 1 + 32 x 1 + 16 x 4 = 24 + 32 + 64 = 120
Menentukan molaritas
![]()
Soal No.103
Tekanan uap air pada 100 oC adalah 760 mmHg. berapakah tekanan uap jenuh larutan glukosa 18% pada 100 oC? (Ar H=1, C=12, O=16)
PEMBAHASAN :
Po = 760 mmHg
% b/b = 18%
Mr glukosa (C6H12O6) = Ar C x 6 + Ar H x 12 + Ar O x 6 = 12 x 6 + 1 x 12 + 16 x 6 = 180
Menentukan berat glukosa dan air
Jika dimisalkan berat total = 100 gr
Maka berat gula = 18% x 100 gr = 18 gr
berat air (100 – 18)% = 82% x 100 gr = 82 gr
Menentukan fraksi mol glukosa
![]()
![]()
![]()
xair = 1 – xglukosa = 1 – 0,021 = 0,979
Menentukan tekanan uap larutan glukosa
PL = Po. xp = 760 mmHg. 0,979 = 744,04 mmHg
Soal No.104
jika 23 gram etanol (C2H5OH) dicampurkan dengan 27 gram air (H2O) dan diketahui Ar C = 12, H = 1, O = 16, hitunglah fraksi mol etanol dan air
PEMBAHASAN :
Mr C2H5OH = Ar C x 2 + Ar H x 6 + Ar O x 1 = 12 x 2 + 1 x 6 + 16 x 1 = 46
Mr H2O = Ar H x 2 + Ar O x 1 = 1 x 2 + 16 x 1 = 18
Menentukan mol etanol
![]()
![]()
Menentukan fraksi mol etanol
![]()
xair = 1 – 0,25 = 0,75
Soal No.105
Tekanan uap jenuh larutan 62 gram zat A dalam 342 gram air adalah 76 cmHg. Pada temperatur yang sama tekanan uap jenuh air murni adalah 80 cmHg.berapa massa molekul relatif zat A?
PEMBAHASAN :
Diketahui:
Gr A = 62 gram
![]()
Gr H2O = 342 gram
![]()
PL = 76 cmHg
Po = 80 cmHg
Menentukan fraksi mol pelarut (air)
PL = Po . Xp
76 = 80 . Xp
![]()
Menentukan Mr zat A
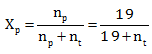
![]()
0,95(19 + nt) = 19
18,05 + 0,95 nt = 19
0,95 nt = 19 – 18,05 = 0,95
![]()
![]()
![]()
Mr = 62
Soal No.106
Titik didih air naik 1,04°C setelah penambahan 3 gram zat elektrolit biner ke dalam 100 gram air .jika Kb air = 0,52 ° C/m , maka Mr zat elektrolit tersebut adalah …
PEMBAHASAN :
Diketahui:
ΔTb = 1,04 oC
n =2 (biner)
Jika dianggap elektrolit kuat maka:
i = n
i = 3
P = 100 gr
Gr = 3 gr
Kb = 0,52 oC
Menentukan Mr zat
ΔTb = Kb . m . i
![]()
![]()
![]()
Soal No.107
Titik didih zat non elektrolit (Mr = 60) dalam 200 gram air adalah 100,104 °C jika Kb air = 0,52°C/molal, massa zat tersebut adalah
PEMBAHASAN :
Mr = 60
P = 200 gr
Tb = 100,104 oC
ΔTb = 100,104 – 100 = 0,104
Kb = 0,52
Menentukan massa zat
ΔTb = Kb. m
![]()
![]()
![]()
Soal No.108
Titik beku suatu larutan yang mengandung 10 gr zat Y (bukan elektrolit) dalam 500 gr air ialah -0,465 derajat Celcius. Jika diketahui tetapan penurunan titik beku molal dari air ialah 1,86. Berapa massa relatifnya?
PEMBAHASAN :
Diketahui:
Gr = 10 gr
P = 500 gr
TfL = -0,465 oC
ΔTf = Tfo – TfL = 0 – (-0,465) = 0,465
Kf = 1,86
Menentukan massa relatifnya
ΔTf = Kf . m

![]()
![]()
Soal No.109
Penurunan titik beku 24,5 gram asam sulfat H2SO4 dalam 2500 gram air sama dengan 2,9 kali penurunan titik beku 7,5 gram CO(NH2)2 dalam 1250 air. berapa derajat ionisasi H2SO4 dalam larutan tersebut
PEMBAHASAN :
Diketahui:
Mr H2SO4 = 98
Mr CO(NH2)2 = 60
Menentukan derajat ionisasi melalui perbandingan
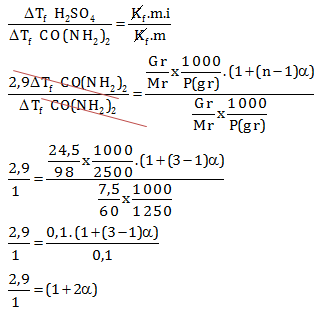
2,9 = 1 + 2α
2α = 1,9
α = 1,9/2 = 0,95
Soal No.110
Tekanan osmosis suatu larutan yang mengandung 1,5 gram zat A (non elektrolit) dalam 500 ml larutan pada suhu 27°C adalah 1,23 atm. Massa molekul relatif zat tersebut adalah
PEMBAHASAN :
Diketahui:
Gr = 1,5 gr
V = 500 ml
T = 27oC = 300 K
Menentukan Mr
π = M. R. T
![]()
![]()
![]()
Soal No.111
Tekanan osmosis larutan CuSO4 0,2 M dengan derajat ionisasi 0,75 pada suhu 27°C (R=0,08) adalah
PEMBAHASAN :
Diketahui
M = 0,2 M
α = 0,75
T = 27oC = 300 K
R = 0,08
n = 2 (dari ionisasi CuSO4 → Cu2+ + SO42-, jumlah ion = 2)
Menentukan tekanan osmosis
π = M. R. T. i
π = 0,2. 0,08. 300. (1 +(n-1) α)
π = 4,8 (1 + (2-1)0,75) = 4,8 . 1,75 = 8,4 atm
Soal No.112
Sebuah larutan mengandung 0,2 mol glukosa dalam 500 ml air. Hitunglah tekanan osmotik larutan pada suhu 25oC jika tetapan gas umum adalah 0,0821 L.atm/K.mol
PEMBAHASAN :
Diketahui:
Mol glukosa (n) = 0,2 mol
Volume larutan (V) = 500 ml = 0,5 L
Faktor Van hoff (i) = 1 (karena glukosa adalah non-elektrolit)
Suhu (T) = 25oC = 298 K
Menentukan tekanan osmotik (π):
π = M.R.T.i
π = n/V.R.T.i
π = 0,2/0,5 . 0,0821 . 298 . 1
π = 9,786 atm
Sumber Soal :
Kimia Untuk SMA/MA Kelas XII Penerbit Erlangga Pengarang Michael Purba & Sunardi
Kimia Untuk SMA/MA Kelas XII Penerbit Erlangga Pengarang Unggul Sudarmo

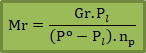
no.27 kenapa mol nya 1/2 yak? emang bukannya i nya di kali yak? kok malah dibagi?
eh salah, bukan no.27, tapi no.31
itu karena nt dikali i nilainya 1. Karena nilai i = 2. maka nt x 2 = 1 sehingga nt = 1/2
no 9 nacl merupakan elektrolit dengan i=2, sehingga jawaban 1,7 cmiiw
itu bukan soal mengenai sifat koligatif. Tapi hanya menentukan molalitas. Jadi tidak perlu dikali faktor van hoff (i)
Makasih banyak Bang, sangat membantu. Btw, apakah yang ini ada versi pdfnya?