Contoh Soal & Pembahasan PAS/UAS Ganjil Kimia Kelas XI Part III
- 0,1
- 0,25
- 0,5
- 0,75
- 1
PEMBAHASAN :
Diketahui Reaksi:
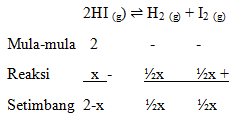
Diketahui perbandingan mol HI dan I2 adalah 2 : 1, maka:
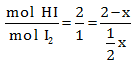
Dengan dikali silang, maka:
2. ½x = 1. (2 – x)
x = 2 – x
2x = 2
x = 1
Sehingga mol masing-masing zat saat setimbang adalah
mol HI = 2 – x = 2 – 1 = 1
mol H2 = mol I2 = ½ x = ½ . 1 = ½
Nilai Kc adalah
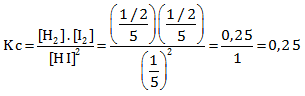
Jawaban B
PEMBAHASAN :
Diketahui
2NO (g) + O2 (g) ⇌ 2NO2 (g) Kc = K1
2NO2 (g) ⇌ 4NO (g) + 2O2 (g) Kc = K2
Perubahan dari reaksi kesatu agar menjadi reaksi kedua adalah
- dibalik
- dikali 2
- ½
- 2
- 8
- 64
- 512
PEMBAHASAN :
Pada kesetimbangan saat suhu tetap maka nilai K tidak akan berubah walaupun volume diubah. Maka jawabannya nilai K saat volume diubah menjadi sepertiganya adalah tetap = 8
Jawaban C
- 1
- 2/3
- 1/3
- 3
- 6
- 0,0885
- 0,0984
- 0,885
- 0,984
- 1,080
PEMBAHASAN :
Menentukan Kp jika diketahui Kc maka dapat menggunakan rumus
Kp = Kc (RT)Δn
T = 27 oC + 273 = 300 K
Δn = Σkoefisien produk – Σkoefisien pereaksi = 2 – 1
Kp = 0,04 (0,082. 300)1
Kp = 0,04. 24,6 = 0,984
Jawaban D
- 0,40 mol
- 0,25 mol
- 2,5 mol
- 3,5 mol
- 4 mol
- Reaksi bergeser ke kanan sehingga dihasilkan gas NH3 lebih banyak
- Pt-Rh berperan untuk mempercepat terjadinya reaksi kesetimbangan
- Laju reaksi ke kanan berlangsung lebih cepat daripada ke kiri
- Pt-Rh akan menyerap NH3 yang dihasilkan sehingga terpisah dari sistem
- Katalis akan menurunkan nilai perubahan entalpi pembentukan
PEMBAHASAN :
Pt-Rh merupakan katalis yang tidak berperan dalam pergeseran kesetimbangan. Tapi katalis dalam reaksi kesetimbangan berperan dalam mempercepat terjadinya reaksi kesetimbangan
Jawaban B
- Konsentrasi gas oksigen akan menjadi setengah dari konsentrasi semula
- Konsentrasi gas SO3 sama dengan konsentrasi semula
- Konsentrasi gas SO3 menjadi lebih kecil dari konsentrasi semula
- Tekanan sistem menjadi lima kali dari tekanan sistem semula
- Perubahan yang terjadi tidak dapat diramalkan
PEMBAHASAN :
Jika volume sistem diperbesar maka reaksi akan bergeser ke koefisien yang besar. Yaitu ke sebelah kiri atau jumlah zat yang sebelah kiri(SO2 dan O2) akan bertambah dan yang sebelah kanan (SO3) akan berkurang. Sehingga jawaban yang tepat adalah C
Jawaban C
- 2SO3 (g) ⇌ 2SO2 (g) + O2 (g)
- N2 (g) + O2 (g) ⇌ 2NO (g)
- N2 (g) + 3H2 (g) ⇌ 2NH3 (g)
- PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)
- 2H2 (g) + O2 ⇌ 2H2O (g)
PEMBAHASAN :
Perubahan tekanan tidak akan terpengaruh ketika koefisien zat yang berwujud gas sama di sebelah kiri dengan sebelah kanan. Seperti yang ditunjukan pilihan B
N2 (g) + O2 (g) ⇌ 2NO (g)
Koefisien zat sebelah kiri adalh 2 dan sebelah kanan juga 2. Maka pengaruh tekanan tidak akan berpengaruh
Jawaban B
- Jumlah ion SCN+ akan bertambah
- Jumlah ion Fe3- akan berkurang
- Jumlah ion FeSCN2- akan bertambah
- Jumlah ion FeSCN2- akan berkurang
- Jumlah ketiga ion tetap
PEMBAHASAN :
Menambahkan larutan FeCl3 berarti menambahkan ion Fe3+. Menurut asas Le Chatelier, jika konsentrasi salah satu zat ditambah maka akan bergeser menjauhi zat yang ditambah tersebut. Jika Fe3+ ditambah maka akan bergeser menjauhi Fe3+ atau bergeser ke kanan yang artinya jumlah ion FeSCN2- akan bertambah
Jawaban C


