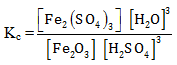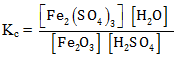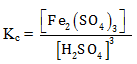Contoh Soal & Pembahasan PAS/UAS Ganjil Kimia Kelas XI Part II
- v = k[A]
- v = k[A][B]
- v = k[A][B]2
- v = k[A]2[B]
- v = k[A]2[B]2
PEMBAHASAN :
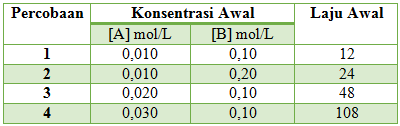
Menentukan Orde A
Cari 2 [B] yang sama yaitu percobaan 3 & 1, Bandingkan percobaan 3 dan 1 untuk [A] dan v
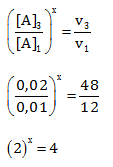
Maka x = 2
Menentukan Orde B
Cari 2 [A] yang sama yaitu percobaan 2 & 1, Bandingkan percobaan 2 dan 1 untuk [B] dan v
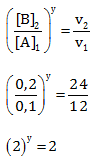
Maka y = 1
Sehingga persamaan laju reaksinya adalah v = k[A]2[B]
Jawaban D
- 2
- 8
- 16
- 32
- 64
PEMBAHASAN :
Diketahui
Kenaikan laju (kv) = 2x
Kenaikan suhu (kT) = 10
Suhu tinggi (T2) = 75 oC
Suhu rendah (T1) = 35 oC
Menentukan perbandingan laju pada suhu tinggi (v2) terhadap laju pada suhu rendah (v1)
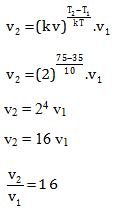
Jawaban C
2NO (g) + Br2 (g) → 2NOBr (g)
Jika kemolaran NO dinaikkan 2 kali dan kemolaran Br2 tetap, laju reaksi 4 kali lebih besar. Jika kemolaran NO dan Br2 dinaikkan 2 kali, laju reaksi menjadi 16 kali lebih besar. Persamaan laju reaksi tersebut adalah?
- r = k[NO]2
- r = k[NO][Br2]
- r = k[NO][Br2]2
- r = k[NO]3[Br2]
- r = k[NO]2[Br2]2
PEMBAHASAN :
Untuk memudahkan dibuatkan tabel
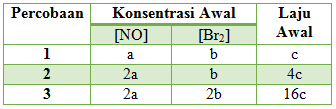
Menentukan Orde NO
Cari 2 [Br2] yang sama yaitu percobaan 2 & 1, Bandingkan percobaan 2 dan 1 untuk [NO] dan v

Maka x = 2
Menentukan Orde Br2
Cari 2 [NO] yang sama yaitu percobaan 3 & 2, Bandingkan percobaan 3 dan 2 untuk [Br2] dan v
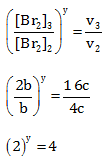
Maka y = 2
Sehingga persamaan laju reaksinya adalah r = k[NO]2[Br2]2
Jawaban E
- Katalis dapat mempercepat laju reaksi dengan cara menaikkan energi aktivasi
- Tahap penentu reaksi adalah tahap reaksi yang berlangsung paling lambat
- Laju reaksi didefinisikan sebagai berkurangnya kemolaran pereaksi tiap satuan waktu
- Semakin besar luas permukaan zat, semakin cepat laju reaksi
- Kenaikan suhu memperbesar laju karena meningkatkan energi kinetik pereaksi
PEMBAHASAN :
Pernyataan yang salah adalah adalah jawaban A karena katalis dapat mempercepat laju reaksi dengan cara menurunkan energi aktivasi atau mencari jalan lain yang energi aktivasinya lebih rendah. semakin rendah energi aktivasi maka semakin mudah reaksi berlangsung sehingga reaksi semakin cepat.
Jawaban A
- Jumlah mol zat bereaksi sama dengan jumlah mol zat hasil reaksi
- Reaksi dari kiri selalu sama kecepatannya dengan reaksi dari kanan
- Reaksi terus berlangsung ke dua arah secara mikroskopis
- Reaksi akan berlangsung secara terus menerus dengan perubuhan mikroskopis
- Jumlah partikel setiap zat yang bereaksi sama dengan jumlah partikel zat yang terbentuk
PEMBAHASAN :
Kesetimbangan dinamis merupakan reaksi bolak balik dimana produk dapat bereaksi kembali membentuk pereaksi. Syarat terjadinya kesetimbangan dinamis adalah kecepatan pereaksi membentuk produk sama dengan kecepatan produk membentuk pereaksi
Jawaban B
- Suhu
- Katalis
- Volume
- Tekanan
- Konsentrasi
PEMBAHASAN :
Faktor-faktor yang mempengaruhi kesetimbangan kimia adalah:
- Konsentrasi
- volume
- tekanan
- suhu
Katalis tidak mempengaruhi reaksi kesetimbangan hanya mempercepat berlangsunnya reaksi
Jawaban B
Pada suhu tetap, volume sistem diperkecil sehingga?
- Kesetimbangan bergeser ke kiri dan nilai K berkurang
- Kesetimbangan bergeser ke kiri, tetapi nilai K tetap
- Kesetimbangan ke kanan dan nilai K bertambah
- Kesetimbangan bergeser ke kanan tetapi nilai K tetap
- Kesetimbangan tidak bergeser
PEMBAHASAN :
Faktor volume dapat menyebabkan pergeseran kesetimbangan, yaitu:
- Jika volume diperbesar akan bergeser ke koefisien yang lebih besar (wujud gas)
- Jika volume diperkecil akan bergeser ke koefisien yang lebih kecil (wujud gas)
Jika volume diperkecil maka reaksi akan bergeser ke kanan atau menuju NH3 karena koefisien kanan (2) lebih kecil dibanding koefisien kiri (1+3). Volume tidak akan mempengaruhi nilai K hanya suhu yang menyebabkan perubahan K
Jawaban D
- Memperkecil tekanan dan menurunkan suhu
- Memperkecil volume dan menaikan suhu
- Memperbesar tekanan dan menaikan suhu
- Memperbesar volume dan menambahkan Katalis
- Menambah konsentrasi SO2 dan menurunkan suhu
PEMBAHASAN :
Agar diperoleh SO3 yang maksimal maka reaksi harus di geser ke kanan menuju SO3. Agar bergeser ke kanan, dapat dilakukan dengan:
- menambah konsentrasi SO2 atau O2. Atau mengurangi konsentrasi SO3
- Volume diperkecil agar bergeser ke koefisien kecil (kanan)
- Tekanan diperbesar agar bergeser ke koefisien kecil (kanan)
- Suhu diturunkan agar bergeser ke reaksi eksoterm (kanan)
Maka jawaban yang tepat adalah E
Jawaban E
PEMBAHASAN :
Untuk menentukan rumus Kc hanya wujud gas (g) dan larutan (aq) yang dapat dimasukan ke rumus Kc, sehingga rumusan Kc adalah

Jawaban E
Nilai tetapan kesetimbangan reaksi tersebut adalah?
- 0,1
- 0,2
- 0,3
- 0,4
- 0,5
PEMBAHASAN :
Diketahui reaksi:
2C (s) + O2 (g) 2CO (g)
Karena diketahui dalam keadaan setimbang maka tinggal dimasukan ke rumus Kc

(dibagi 10 karena dibagi volume untuk mengubah mol menjadi molaritas)
Jawaban A