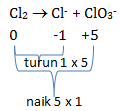Contoh Soal & Pembahasan Reaksi Redoks SBMPTN Kimia SMA
Diketahui reaksi :
3HOCl + NaI → NaIO3 + 3HCl
Dalam suatu larutan NaI 0,05 M dan 100 ml HOCl hasil pengenceran dari 5 ml larutan HOCl 3 M
- 3 mol
- 4 mol
- 5 mol
- 6 mol
- 7 mol
PEMBAHASAN :

Maka untuk 1 mol NaI (koefisiennya 1) akan terlibat 6 elektron
Jawaban D
Diketahui reaksi:
6H+ + 5SO32- + 2MnO4– → 5SO42- + 2Mn2+ + 3H2O
Dalam suatu reaksi digunakan 100 ml larutan H2SO3 0,1 M dan 100 ml KMnO4 yang didapat dari pengenceran 5 ml KMnO4 2 M
- 2 mol
- 5 mol
- 7 mol
- 10 mol
- 14 mol
PEMBAHASAN :

Jumlah elektron untuk 5 mol SO32- sesuai dengan koefisennya = 5 adalah 10 mol elektron
Jawaban D
Jika 0,3 mol gas brom terdisproporsionisasi secara sempurna, jumlah mol elektron yang terlibat adalah…
- 0,1
- 0,2
- 0,3
- 0,4
- 0,5
PEMBAHASAN :
Reaksi tersebut sudah disetarakan tinggal menentukan jumlah elektron yang terlibat
Jumlah elektron yang terlibat dilihat dari naik turun biloks yaitu 5. Jumlah elektron = 5 untuk mol Br2 = 3 mol (dilihat dari koefisien). Maka untuk 0,3 mol dapat ditentukan jumlah elektronnya melalui perbandingan:
![]()
![]()
Jawaban E
- C(s) + H2SO4(aq) → CO2(g) + H2O(l) + SO2(g)
- Na2S2O3(aq) + I2(aq) → Na2S4O6(aq) + NaI(aq)
- S(s) + O2(g) → SO2(g)
- SO3(g) + H2SO4(aq) → H2S2O7(aq)
Jawaban yang benar adalah 1,2 dan 3
Jawaban A
- Fe3O4(s) + HCl(aq) + FeCl3(aq) + FeCl2(aq) + H2O(l)
- NH3(g) + O2(g) → NO(g) + H2O(g)
- H2O(l) + SO2(g) → H2SO3(aq)
- SO2(g) + O2(g) → SO3(g)
PEMBAHASAN :

Maka jawaban yang benar adalah 2 dan 4
Jawaban C
- 1/5
- 1/3
- 1/2
- 1
- 2
PEMBAHASAN :
Reaksi tersebut merupakan reaksi autoredoks/disproporsionisasi dimana hanya Cl yang mengalami reduksi dan oksidasi
Langkah menyetarakan reaksi autoredoks
- Samakan naik turun biloks. Pengali menjadi koefisien produk
Cl2 → 5Cl– + ClO3–
- Samakan jumlah atom Cl di kiri dan kanan
3Cl2 → 5Cl– + ClO3–
Penyetaraan cukup sampai disini karena hanya diperlukan perbandingan antara ClO3– dengan Cl2
Untuk 1 mol Cl2 maka mol ClO3–
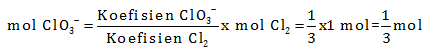
Jawaban B
- NO3– + 4Zn + 6H2O + 7OH– → 4Zn(OH)42- + NH3
- 8H+ + 2NO3– + 6I– → 2NO + 3I2 + 4H2O
- 2NO2 + 7H2 → 2NH3 + 4H2O
- NO +CH2O2 → NO2 + CH2O
- 2 : 1
- 1 : 5
- 6 : 5
- 3 : 3
- 5 : 3
PEMBAHASAN :
Reaksi tersebut merupakan reaksi antiautoredoks/konproporsionisasi dimana hasil reduksi dan oksidasi sama yaitu I2.
Langkah menyetarakan reaksi antiautoredoks
- Samakan naik turun biloks. Pengali menjadi koefisien pereaksi
IO3–(aq) + 5I–(aq) + H+(aq) → I2(aq) + H2O(l)
- Samakan jumlah atom I di kiri dan kanan
IO3–(aq) + 5I–(aq) + H+(aq) → 3I2(aq) + H2O(l)
Penyetaraan cukup sampai disini karena hanya diperlukan perbandingan antara I– dengan I2
Maka perbandingan koefisien / mol dari I– dan I2 adalah 5 : 3
Jawaban A
- +1
- +2
- +3
- +4
- +5
PEMBAHASAN :
Diketahui 2 mol VOn– bereaksi dengan 3 mol Zn, maka koefisiennya

V di kali 2 karena dilihat dari koefisien/mol nya = 2
Zn di kali 3 karena dilihat dari koefisien/ molnya = 3
Jumlah elektron yang terlibat akan sama
(x-2) x 2 = 2 x 3
2x – 4 = 6
2x = 10
x = +5
Maka biloks V dalam VOn– adalah +5
Jawaban E
- 5 mol
- 10 mol
- 15 mol
- 20 mol
- 25 mol