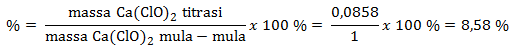Contoh Soal & Pembahasan Bab Kimia Unsur Kelas 12
Soal No.1
Jelaskan beberapa faktor yang menyebabkan gas mulia sukar bereaksi dengan unsur lain
PEMBAHASAN :
- Konfigurasi elektron gas mulia (Kecuali He) berakhir pada ns2np6 yang merupakan konfigurasi elektron stabil, karena semua elektronnya sudah berpasangan.
- Energi ionisasinya tinggi yang menyebabkan sulit melepaskan elektron menghasilkan ion positif
- Afinitas elektronnya yang rendah sehingga gas mulia sukar mengikat elektron untuk menjadi ion negatif.
Mengapa gas mulia dalam keadaan bebas bertindak sebagai gas monoatomik
PEMBAHASAN :
Karena sulitnya gas mulia membentuk ikatan dengan unsur yang lain
Hal apa yang mendorong Niels Bartlett berkeyakinan bahwa Xe dapat bereaksi dengan PtF6 membentuk XePtF6?
Energi ionisasi molekul oksigen yang dapat bereaksi dengan PtF6 sedikit lebih tinggi dari pada energi ionisasi Xe, maka dicobalah mereaksikan Xe dengan PtF6
Mengapa senyawa gas mulia yang dapat disintesis baru terbatas pada Kr, Xe, dan Rn?
PEMBAHASAN :
Karena He, Ne, dan Ar masih memiliki energi ionisasi yang tinggi yang sulit untuk melepaskan elektron dibandingkan Kr, Xe dan Rn yang energi ionisasinya lebih rendah (lebih mudah melepas elektron).
Perkirakan bentuk molekul XeF4 dan KrF2 dengan menggunakan teori VSEPR.
Teori VSEPR menjelaskan adanya tolakan antara pasangan elektron PEB dengan PEB, PEI dengan PEB dan PEI dengan PEI. Untuk melihat bentuknya maka harus digambarkan struktur lewisnya
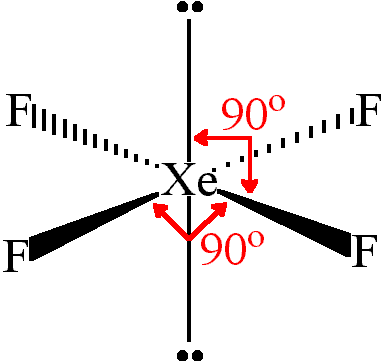
Bentuk molekul XeF4 : Segiempat planar
KrF2
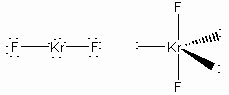
Bentuk Molekul : Linear
Sumber gambar : bilbo.chm.uri.edu
Jelaskan faktor-faktor yang menyebabkan halogen sangat reaktif
- Kofigurasi elektronnya, dengan sebuah elektron tak berpasangan pada konfigurasi elektronnya, memungkinkan halogen dengan mudah membentuk ikatan kovalen
- Afinitas elektronnya yang tinggi mengakibatkan halogen mudah membentuk ion negatif dan membentuk senyawa dengan berikatan ion.
Mengapa halogen di alam lebih banyak didapati sebagai senyawa dengan bilangan oksidasi -1?
PEMBAHASAN :
Karena dengan e.v = 7 maka akan mudah bagi halogen mencapai kestabilan dengan menangkap 1 elektron sehingga membentuk ion X–
Bagaimana kecenderungan perubahan sifat halogen berikut dari F ke I dan jelaskan alasannya
a. Energi Ionisasi
b. Afinitas elektron
c. Titik didih dan titik leleh
d. Daya oksidasi dan daya reduksi
Dari F ke I :
- Energi Ionisasi Semakin Kecil artinya semakin mudah melepas elektron karena jari-jari atom semakin besar sehingga semakin jauh jarak inti ke kulit terluar semakin mudah melepas elektron
- Afinitas elektron semakin kecil artinya semakin sulit menangkap elektron karena jari-jari atom semakin besar semakin jauh jarak inti ke elektron yang akan ditangkap
- Titik didih dan titik leleh semakin besar karena semakin besar nilai Mrnya dimana di gaya van der waals semakin besar Mr semakin kuat ikatannya dan titik didihnya semakin tinggi
- Daya oksidasi semakin kecil karena semakin sulit mengalami reduksi akibat afinitas elektronnya semakin kecil, Daya reduksi semakin besar karena energi ionisasinya semakin besar.
Tuliskan persamaan reaksi yang terjadi jika:
a. Gas klorin dialirkan ke dalam serbuk besi
b. Uap iodin dialirkan ke dalam NaOH pekat panas
c. Gas klorin dialirkan ke dalam larutan kalium Iodida
PEMBAHASAN :
a. Fe(s) + Cl2(g) → FeCl2(s)
b. 3I2(g) + 6NaOH(aq) → 5I–(aq) + IO3–(aq) + 3H2O(l)
c. Cl2(g) + 2KI(aq) → 2KCl(aq) + I2(g)
Jelaskan mengapa senyawa halida banyak terdapat di air laut
PEMBAHASAN :
Karena di air laut terdapat berbagai ion logam yang dapat bereaksi dengan ion halogen membentuk garam
Dengan menggunakan nilai potensial elektrodenya (Eo), tentukan reaksi berikut yang dapat berlangsung
a. F2(g) + Cl–(aq) →
b. Cl2(g) + I–(aq) →
c. Cl2(g) + F–(aq) →
d. Br2(g) + Cl–(aq) →
PEMBAHASAN :
a. F2(g) + 2Cl–(aq) → 2F–(aq) + Cl2(g) (berlangsung)
b. Cl2(g) + 2I–(aq) → 2Cl–(aq) + I2(g) (berlangsung)
c. Cl2(g) + F–(aq) → (tidak berlangsung)
d. Br2(g) + Cl–(aq) → (tidak berlangsung)
Tuliskan reaksi yang terjadi
a. NaF(s) + H2SO4(l) →
b. NaI(s) + H2SO4(l) →
c. NaCl(s) + H2SO4(l) + MnO2(s) →
d. NaBr(s) + H3PO4(l) →
- NaF(s) + H2SO4(l) → Na2SO4(aq) + 2HF(g)
- NaI(s) + H2SO4(l) → NaHSO4(s) + HI(g)2HI(g) + H2SO4(l) → SO2(g) + I2(g) + 2H2O(l)
- 2NaCl(s) + 2H2SO4(l) + MnO2(s) → Na2SO4(s) + MnSO4(s) + 2H2O(l) + Cl2(g)
- NaBr(s) + H3PO4(l) → NaH2PO4(s) + HBr(g)
Hidrogen halida yang dilarutkan dalam air akan membentuk larutan asam halida. Di antara asam halida yang ada, larutan asam halida manakah yang merupakan asam terkuat? Jelaskan
PEMBAHASAN :
Asam halida yang paling kuat adalah asam halida karena jari-jari atomnya semakin panjang, sehingga kekuatan ikatan H-I sangat lemah, akibatnya ion H+ semakin mudah lepas.
Diantara asam : HClO, HClO2, HClO3, dan HClO4, asam manakah yang paling kuat? Jelaskan
PEMBAHASAN :
Semakin banyak oksigen, semakin kuat pula ikatan antara Cl-O akibatnya H+ akan lebih mudah dilepaskan karena ikatan antara O-H lebih lemah sehingga yang paling kuat adalah HClO4
Di antara asam : HClO3, HBrO3, dan HIO3, asam manakah yang paling kuat? Jelaskan
PEMBAHASAN :
Yang paling kuat yaitu HClO3 karena Cl memiliki keelektronegatifan yang lebih tinggi dibanding Br dan I yang menyebabkan ikatan X-O lebih kuat dan ikatan O-H lemah yang menyebabkan H+ lebih mudah lepas
Di dalam empat gelas kimia yang berbeda terdapat larutan yang mengandung NaI, NaCl, NaBr, dan NaI secara terpisah. Jika tidak terdapat label pada gelas kimia tersebut, bagaimana cara anda membedakan masing-masing senyawa? Tuliskan reaksinya.
Untuk membedakan ion halida dilakukan dengan penambahan larutan Pb2+ apabila terbentuk endapan putih kemungkinan ion halidanya F– atau Cl– akan tetapi bila endapannya berwarna kuning berarti ion halidanya adalah ion Br– atau I–. Reaksinya:
Pb2+(aq) + NaF(aq) → Na+(aq) + PbF2(s)
Untuk membedakan ion F– dan Cl‑ maka ke dalam larutan ditambahkan Ag+. Apabila tidak terbentuk endapan berarti ion halidanya adalah ion F– dan bila terbentuk endapan putih berarti ion halidanya ion Cl–. Untuk membedakan ion Br– dan I–, maka larutan direaksikan dengan Ag+ dan endapan didekantasi kemudian ditambahkan NH3 pekat. Bila endapan larut berarti yang ada dalam larutan adalah ion Br– dan bila tidak larut berarti yang ada dalam larutan adalah ion I–
Suatu larutan tak berwarna dari natrium halida jika direaksikan dengan larutan perak nitrat akan menghasilkan endapan kuning yang dapat larut dalam amonia pekat. Jenis halida manakah yang terdapat dalam larutan tersebut? Tuliskan reaksi yang terjadi.
Jenis halidanya yaitu yang mengandung ion Br–
Br–(aq) + AgNO3(aq) → AgBr(s) + NO3‑(aq)
Endapan Kuning
Jika di dalam larutan terdapat ion Cl– yang bercampur dengan ion I–, bagaimana cara anda memisahkan kedua ion tersebut dari dalam larutan?
PEMBAHASAN :
Direaksikan dengan larutan yang mengandung ion Ag+ kemudian dilarutkan dalam amonia cair. Perak klorida dapat larut dalam amonia sedangkan perak iodida tidak dapat larut dalam amonia encer.
Untuk menetapkan kadar iodin dalam zat yang mengandung NaIO3, diambil 2 gram zat,kemudian dilarutkan ke dalam 100 mL air. Sebanyak 20 mL larutan tersebut diasamkan dan direaksikan dengan larutan KI berlebih. I2 yang dibebaskan tepat habis bereaksi dengan 12 mL larutan Na2S2O3 0,1 M. Jika Ar Na = 23, O = 16, dan I = 127, tentukan kadar iodin dalam zat tersebut
Reaksi titrasi Iodometri
5I–(aq) + IO3–(aq) + 6H+(aq) → 3I2(aq) + 3H2O(l)
I2(aq) + 2S2O32-(aq) → S4O62-(aq) → S4O62-(aq) + 2I–(aq)
Menentukan mol Na2S2O3
n = M x V
n = 0,1 M x 12.10-3L = 1,2 x 10-3 mol
berdasarkan perbandingan mol I2 dengan S2O32- melalui perbandingan koefisien, didapat mol I2:
I2(aq) + 2S2O32-(aq) → S4O62-(aq) + 2I–(aq)
6 x 10-4 mol 1,2 x 10-3 mol
mol I2 = ½ x 1,2 x 10-3 = 0,6 x 10-3 = 6 x 10-4 mol
Bandingkan kembali koefisien I2 dengan IO3– untuk mendapatkan mol IO3–
5I–(aq) + IO3–(aq) + 6H+(aq) → 3I2(aq) + 3H2O(l)
Mencari massa NaIO3 hasil titrasi:
Gr = n x Mr = 2 . 10-4 x 198 = 0,0396 gram
Menentukan Kadar
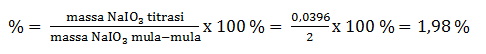
Untuk menentukan kadar klorin dalam kaporit (Ca(ClO)2) diambil 1 gram kaporit, kemudian dilarutkan ke dalam air sampai volumenya 100 cm3. Dari larutan yang terjadi diambil 20 cm3, kemudian diasamkan dan direaksikan dengan KI berlebih. I2 yang terbentuk dititrasi dengan larutan standar Na2S2O3 0,2 M dengan indikator amilum. Warna biru hilang setelah volume Na2S2O3 terpakai 12 mL. Jika Ar Ca = 40, O = 16, dan Cl = 35,5, tentukan kadar klorin dalam kaporit tersebut
Reaksi titrasi Iodometri
2I–(aq) + ClO–(aq) + 2H+(aq) → I2(aq) + Cl–(aq) + H2O(l)
I2(aq) + 2S2O32-(aq) → S4O62-(aq) + 2I–(aq)
Menentukan mol Na2S2O3
n = M x V
n = 0,2 M x 12.10-3L = 2,4 x 10-3 mol
berdasarkan perbandingan mol I2 dengan S2O32- melalui perbandingan koefisien, didapat mol I2:
I2(aq) + 2S2O32-(aq) → S4O62-(aq) → S4O62-(aq) + 2I–(aq)
1,2 x 10-3 mol 2,4 x 10-3 mol
mol I2 = ½ x 2,4 x 10-3 = 1,2 x 10-3 mol
Bandingkan kembali koefisien I2 dengan ClO– untuk mendapatkan mol IO3–
2I–(aq) + ClO–(aq) + 2H+(aq) → I2(aq) + Cl–(aq) + H2O(l)
Ca(ClO)2 (aq) → Ca2+(aq) + 2ClO– (aq)
6 x 10-4 mol 1,2 x 10-3 mol
Mol Ca(ClO)2 = ½ x 1,2 x 10-3 = 6 x 10-4 mol
Mencari massa Ca(ClO)2 hasil titrasi:
Gr = n x Mr = 6 x 10-4 mol x 143 = 0,0858 gram
Menentukan Kadar