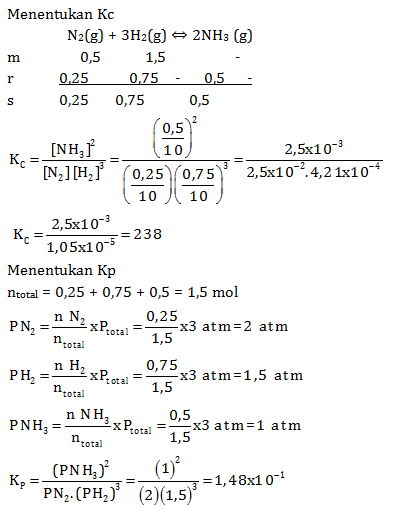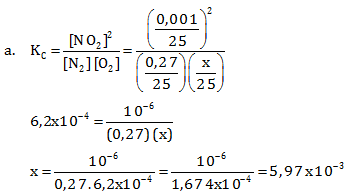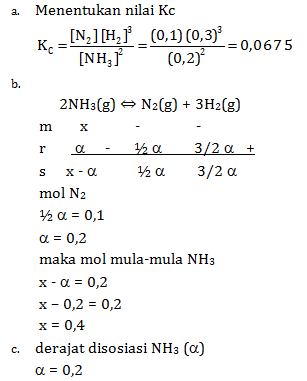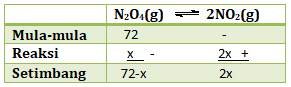DAFTAR ISI
49 Contoh Soal Reaksi Kesetimbangan Dan Pembahasannya
PEMBAHASAN :
reaksi yang berlangsung searah (berkesudahan) yaitu reaksi kimia di mana zat-zat hasil reaksi tidak dapat saling bereaksi kembali menjadi zat pereaksi contohnya :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sedangkan reaksi dapat balik (bolak-balik) yaitu reaksi kimia di mana zat-zat hasil reaksi dapat saling bereaksi kembali menjadi zat pereaksi, contohnya:
PbSO4(s) + 2NaI(aq) ⇔ PbI2(s) + Na2SO4(aq)
PEMBAHASAN :
Reaksi kesetimbangan yaitu reaksi dimana komponen zat-zat pereaksi dan zat hasil reaksi tetap ada dalam sistem, dalam keadaaan setimbang laju reaksi ke kanan sama dengan laju reaksi ke kiri.
syarat-syarat agar dapat menjadi reaksi setimbang:
1. Reaksi bolak-balik
2. Sistem tertutup
3. Bersifat dinamis
PEMBAHASAN :
Karena produk dapat bereaksi kembali membentuk pereaksi. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis
3A2 + 2B2 ⇔ 2A3B2
Pada saat kesetimbangan tercapai, zat A2 telah bereaksi sebanyak 1 mol. Tentukan komposisi masing-masing zat pada keadaan setimbang
PEMBAHASAN :
Reaksi : 3A2 + 2B2 ⇔ 2A3B2
M 2 3 –
R 1 2/3 – 2/3 +
S 1 7/3 2/3
Jadi mol dalam keaadaan setimbang
A2 = 1 mol
B2 = 7/3 mol
A3B2 = 2/3 mol
N2(g) + 3H2(g) ⇔ 2NH3(g)
Pada saat kesetimbangan tercapai, volume sistem menjadi 40 mL. Jika volume diukur pada suhu dan tekanan yang sama, tentukan komposisi (volume masing-masing gas) pada saat kesetimbangan
PEMBAHASAN :
Reaksi : N2(g) + 3H2(g) ⇔ 2NH3(g)
M 20 25 –
R 1/2 x 3/2 x – x +
S 20-1/2x 25 – 3/2x x
volume total = 40 L = 20 – 1/2x + 25 – 3/2x + x
40 = 45 – x
x = 45 – 40
x = 5
volume dalam keadaan setimbang:
N2 = 20 – 1/2(5) = 17,5 L
H2 = 25 – 3/2x = 25 – 3/2(5) = 17,5 L
NH3 = 5 L
a. PCl5(g) ↔ PCl3(g) + Cl2(g)
b. 2SO3(g) + 2Cl2(g) ↔ 2SO2Cl2(g) + O2(g)
c. CO(g) + 2H2(g) ↔ CH3OH(g)
d. Cu2+(aq) + Zn(s) ↔ Zn2+(aq) + Cu(s)
e. 2NH3(g) + CO2(g) ↔ NH2CO2NH4(s)
PEMBAHASAN :

2N2(g) + O2(g) ⇔ 2N2O(g)
Jika pada saat tercapai kesetimbangan terdapat 0,3 mol gas nitrogen, hitunglah nilai tetapan kesetimbangannya
PEMBAHASAN :
Reaksi : 2N2(g) + O2(g) ⇔ 2N2O(g)
M 0,5 0,5 –
R 0,2 0,1 – 0,2 +
S 0,3 0,4 0,2

H2(g) + I2(g) ↔ 2HI(g)
pada To adalah 4. Tentukan tetapan kesetimbangan (K) bagi reaksi:
HI(g) ↔ 1/2 H2(g) + 1/2 I2(g)
PEMBAHASAN :
Reaksi yang ditanyakan merupakan reaksi yang diketahui yang di balik dan di bagi 2.
jika reaksi dibalik maka Kbaru = 1/Klama
jika dibagi x maka K baru = ![]()
maka K baru = 
PCl5(g) ↔ PCl3(g) + Cl2(g)
Tentukan niai tetapan kesetimbangan bagi reaksi tersebut pada ToC
PEMBAHASAN :

CO(g) + 1/2 O2 ↔ CO2(g) K = 1,1 x 1011
H2O(g) ↔ H2(g) + 1/2 O2(g) K = 7,1 x 10-12
Tentukan nilai tetapan kesetimbangan (K) pada suhu 1.000 K untuk reaksi:
CO(g) + H2O(g) ↔ CO2(g) + H2(g)
PEMBAHASAN :
kedua reaksi dijumlahkan:
CO(g) + 1/2 O2 ↔ CO2(g) K1 = 1,1 x 1011
H2O(g) ↔ H2(g) + 1/2 O2(g) K2 = 7,1 x 10-12
zat yang ada di bagian kiri dan kanan bisa di coret, sehingga penjumlahan kedua reaksi menghasilkan reksi:
CO(g) + H2O(g) ↔ CO2(g) + H2(g) dengan K = K1 x K2 = 1,1 x 1011 x 7,1 x 10-12 = 7,81 x 10-1
A(g) + B(g) ↔ 2C(g) + D(g)
Terdapat 2 mol gas A, 3 mol gas B, 4 mol gas C, dan 2 mol gas D. Tekanan ruangan pada kesetimbangan adalah 2,2 atm. Hitunglah nilai Kp untuk kesetimbangan tersebut
PEMBAHASAN :
Menentukan tekanan parsial masing-masing zat

Menentukan Kp

N2(g) + 3H2(g) ↔ 2NH3(g)
Ternyata pada saat setimbang terdapat gas N2 sebanyak 0,25 mol. Hitunglah Kp dan Kc pada saat itu
PEMBAHASAN :
Reaksi N2(g) + 3H2(g) ↔ 2NH3(g)
M 0,5 1,5 –
R 0,25 0,75 – 0,5 +
S 0,25 0,75 0,5

NH4Cl(s) ↔ NH3(g) + HCl(g)
Pada saat setimbang terdapat 0,5 mol gas HCl dan tekanan ruangan pada saat itu adalah 5 atm, hitunglah nilai Kp kesetimbangan tersebut.
PEMBAHASAN :
Reaksi NH4Cl(s) ↔ NH3(g) + HCl(g)
M x – –
R 0,5 0,5 – 0,5 +
S x-0,5 0,5 0,5

N2(g) + 3H2 ↔ 2NH3(g)
pada 400 K mempunyai nilai Kp = 100. Hitunglah nilai Kc untuk kesetimbangan tersebut
PEMBAHASAN :

2SO2(g) + O2(g) ↔ 2SO3(g) Kp = 6,7 x 104
Jika tekanan parsial gas SO2 = 1,2 atm; gas O2 = 3,4 atm; dan gas SO3 = 4 atm, selidikilah apakah sistem tersebut sudah dalam keadaan setimbang atau belum
PEMBAHASAN :

Karena Qp ≠ Kp maka sistem tersebut belum dalam keadaan setimbang
2SO3(g) ↔ 2SO2(g) + O2(g)
Setelah terjadi kesetimbangan ternyata di dalam sistem terdapat 0,1 mol gas oksigen. Hitunglah nilai derajat disosiasinya (α)
PEMBAHASAN :
Reaksi: 2SO3(g) ↔ 2SO2(g) + O2(g)
M 0,5 – –
R 0,2 – 0,2 0,1 +
S 0,3 0,2 0,1

PEMBAHASAN :
Reaksi : 2NO2(g) ↔ 2NO(g) + O2(g)
M 2 – –
R 0,8 – 0,8 0,4 +
S 1,2 0,8 0,4

2NH3(g) ↔ 2NH2(g) + H2(g)
Jika derajat disosiasi, α = 0,2; hitunglah nilai tetapan kesetimbangannya (Kc)
PEMBAHASAN :
mol reaksi = α x mol mula-mula = 0,2 x 0,1 = 0,02 mol
Reaksi : 2NH3(g) ↔ 2NH2(g) + H2
M 0,1 – –
R 0,02 – 0,02 0,01 +
S 0,08 0,02 0,01

CH3COOH(aq) ↔ CH3COO–(aq) + H+(aq)
dengan derajat disosiasi, α = 0,1. Hitunglah konsentrasi ion H+ di dalam larutan.
PEMBAHASAN :
Molaritas reaksi = α x molaritas mula-mula = 0,1 x 0,1 = 0,01 M
Reaksi: CH3COOH(aq) ↔ CH3COO–(aq) + H+(aq)
M 0,1 – –
R 0,01 – 0,01 0,01 +
S 0,09 0,01 0,01
maka konsentrasi ion H+ dalam larutan adalah 0,01 M
CaCO3(s) ↔ CaO(s) + CO2(g)
Volume CO2 yang terdapat pada saat setimbang adalah 22,4 mL. hitunglah derajat disosiasi (α) dan nilai tetapan kesetimbangan (Kp).
PEMBAHASAN :
menentukan mol CaCO3
mol = Gr/Mr = 5 gr/100 = 0,05 mol
menentukan mol CO2
jika dilakukan pada P = 1 atm, maka:

Reaksi : CaCO3(s) ↔ CaO(s) + CO2(g)
M 0,05 – –
R 0,00039 – 0,00039 0,00039+
S 0,0496 0,00039 0,00039
Menentukan α

Menentukan Kp
a. 4NH3(g) + 5O2(g) ↔ 4NO(g) + 6H2O(g)
b. N2(g) + O2(g) ↔ 2NO(g)
PEMBAHASAN :
Jika tekanan dinaikan maka akan bergeser ke jumlah koefisien yang lebih kecil
a. Reaksi akan bergeser ke kiri karena bagian kiri memiliki jumlah koefisien yang lebih kecil
b. tekanan tidak akan menggeser reaksi karena kedua bagian memiliki koefisien yang sama
Fe2O3(s) + 3CO(g) ⇔ 2Fe(s) + 3CO2(g) ΔH = +24,8 kJ
Bagaimanakah besi yang dihasilkan jika:
a.tekanan diperbesar,
b. volume ruangan diperbesar,
c. ditambah Fe2O3,
d. konsentrasi gas CO diperbesar
PEMBAHASAN :
a. tekanan diperbesar akan menggeser ke reaksi dengan jumlah koefisien yang kecil (wujud gas), karena yang berwujud gas di kedua sisi sama jumlah koefisiennya, maka tekanan tidak mempengaruhi reaksi kesetimbangan
b. volume diperbesar akan menggeser ke reaksi dengan jumlah koefisien yang besar (wujud gas), karena yang berwujud gas di kedua sisi sama jumlah koefisiennya, maka volume tidak mempengaruhi reaksi kesetimbangan
c. karena Fe2O3 berwujud padat maka tidak akan menggeser reaksi kesetimbangan
d. konsentrasi gas CO diperbesar maka reaksi akan bergeser ke kanan atau menjauhi zat yang ditambah konsentrasinya
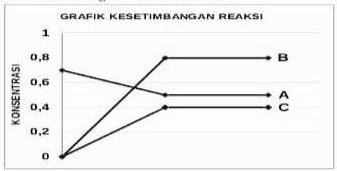
A(g) ⇔ 2B(g)
diperoleh data eksperimen konsentrasi A dan B pada saat setimbang di berbagai suhu sebagai berikut:

Dari data tersebut hitunglah nilai Kp untuk setiap suhu, kemudian jelaskan apakah reaksinya eksoterm atau endoterm
PEMBAHASAN :

Karena dengan naiknya suhu nilai K semakin kecil artinya dengan naiknya suhu reaksi bergeser ke kiri. Agar reaksi bergeser ke kanan maka suhu harus diturunkan atau reaksinya Eksoterm
CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
Pada suhu ToC terdapat dalam kesetimbangan gas CO2 dan gas H2 masing-masing 2 mol serta gas CO dan uap air masing-masing 4 mol. Pada suhu yang tetap ditambahkan 4 mol gas CO2 dan 4 mol gas H2. Bagaimanakah komposisi setelah tercapai kesetimbangan yang baru
PEMBAHASAN :
Untuk suhu tetap nilai K tidak berubah atau K1 = K2
mol CO2 sesudah ditambah = 6 mol
mol H2 sesudah ditambah = 6 mol
karena yang ditambah dibagian kiri maka reaksi akan bergeser ke kanan
Reaksi: CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
M 6 6 4 4
R x x – x x +
S (6-x) (6-x) (4+x) (4+x)

Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
- N2(g) + 3H2(g) ⇔ 2NH3 (g)
- Fe3+(aq) + SCN–(aq) ⇔ FeSCN2+ (aq)
- Fe2O3(s) + 3CO(g) ⇔ 2Fe(s) + 3CO2(g)
- CH3COOH(l) + C2H5OH(l) ⇔ CH3COOC2H5(l) + H2O(l)
- Cu2+(aq) + Zn(s) ⇔ Cu(s) + Zn2+(aq)
Jika nilai tetapan kesetimbangan pada suhu tersebut adalah 36, tentukan konsentrasi masing-masing gas pada saat setimbang.
PEMBAHASAN :
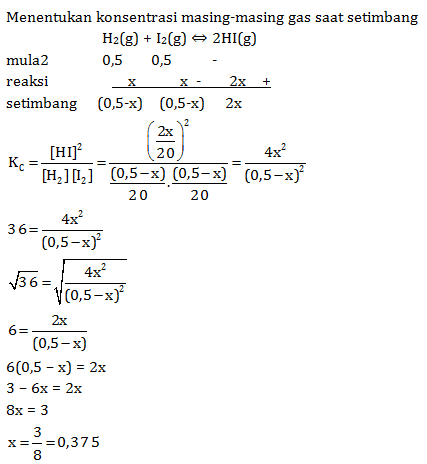
Maka jumlah mol zat dalam keadaan setimbang:
nH2 = 0,5 – 0,375 = 0,125 mol
nI2 = 0,5 – 0,375 = 0,125 mol
nHI = 2 x 0,375 = 0,75 mol
Pada saat setimbang terdapat 0,25 mol gas N2 dan tekanannya 3 atm. Hitung nilai Kc dan Kp
Apa yang terjadi jika ke dalam sistem tersebut:
- ditambahkan HCl pekat
- ditambah air
- ditambah BiOCl
PEMBAHASAN :
- Penambahan HCl akan menyebabkan reaksi bergeser ke kiri atau menjauhi HCl karena penambahan konsentrasi menyebabkan reaksi bergeser menjauhi zat yang di tambah
- tidak akan mempengaruhi kesetimbangan karena berwujud liquid atau cairan tidak mengalami perubahan konsentrasi sehingga tidak menyebabkan perubahan Kc
- penambahan BiOCl yang berwujud padat tidak akan menyebabkan pergeseran kesetimbangan karena berwujud padat tidak akan mengalami perubahan konsentrasi sehingga tidak akan menyebabkan perubahan Kc
Bagaimanakah kondisi ideal yang tepat agar didapatkan hasil sebanyak-banyaknya?
PEMBAHASAN :
Agar dihasilkan SO3 sebanyak-banyaknya maka reaksi harus bergeser ke kanan, koefisien kanan lebih kecil dibandingkan koefisien kecil, maka cara agar diperoleh hasil sebanyak-banyaknya.
- Konsentrasi SO2 dan O2 ditambah
- Volume diperkecil (bergeser ke koefisien yang kecil)
- Tekanan diperbesar (bergeser ke koefisien yang kecil)
Tetapan kesetimbangan pada suhu 2.000oC adalah 6,2 x 10-4
- Jika pada bejana yang volumenya 25 liter terdapat 0,27 mol N2; 0,001 mol NO2; dan x mol O2 dalam keadaan setimbang, tentukan nilai x
- Apa yang terjadi pada campuran tersebut jika suhunya diturunkan menjadi 1.500 oC
PEMBAHASAN :
b. Jika suhu diturunkan maka reaksi bergeser ke reaksi eksoterm. Dari data reaksi diperlihatkan DH reaksi ke kanan adalah endoterm (+) sebaliknya reaksi ke kiri adalah eksoterm (-). Maka jika suhu diturunkan maka reaksi akan bergeser ke kiri (eksoterm)
2SO2(g) + O2(g) ⇔ 2SO3(g) ΔH = -198 kJ
Gas SO2 dan O2 sebanyak 1,5 mol dan 0,5 mol dimasukkan ke dalam ruang katalisator dengan tekanan awal 3 atm dan suhu 430oC. Pada saat kesetimbangan, diperoleh perbandingan mol SO3 : O2 = 2 : 1 dan tekanan gas SO3 1,9 atm.
- tentukan tekanan gas SO2 dan O2 pada saat setimbang
- Tentukan nilai Kp
C(s) + H2O(g) ⇔ H2(g) + CO(g) ΔH = +131 kJ
- Tuliskan rumusan tetapan kesetimbangan
- Bagaimana komposisi dalam sistem kesetimbangan jika tekanan sistem dinaikkan?
- Jika pada suhu 730oC dalam sistem kesetimbangan tersebut tekanan parsial uap air = 90 atm, tekanan parsial CO = 100 atm, dan tekanan parsial gas H2 = 183 atm, tentukan nilai tetapan kesetimbangannya.
PEMBAHASAN :

- Tekanan sistem dinaikan akan menggeser reaksi kesetimbangan ke jumlah koefisien yang lebih kecil. Koefisien sebelah kiri = 1, koefisien kanan = 2. koefisien C tidak dimasukan karena berwujud solid/padat. Maka jika tekanan diperbesar akan bergeser ke koefisien yang kecil atau ke kiri. jumlah H2O bertambah banyak, H2 dan CO berkurang.
2NH3(g) ⇔ N2(g) + 3H2(g)
Jika komposisi gas-gas dalam kesetimbangan adalah 0,1 mol gas N2; 0,3 mol gas H2; dan 0,2 mol gas NH3; tentukan:
- nilai Kc
- komposisi awal sebelum NH3 terurai
- derajat disosiasi NH3
Fe2O3(s) + 3 CO(g) ⇔ 2Fe(s) + 3CO2(g) ΔH =+ a kJ
Reaksi kesetimbangan terjadi pada suhu 1.900 K dan mempunyai nilai tetapan kesetimbangan Kp = 2,3.
- Bagaimanakah besi yang dihasilkan jika tekanan diperbesar?
- Bagaimanakah besi yang dihasilkan jika ke dalamnya ditambahkan Fe2O3?
- Bagaimanakah besi yang dihasilkan jika suhu dinaikkan?
- Bagaimanakah nilai Kp jika pada suhu tetap ke dalam sistem kesetimbangan ditambah gas CO?
- Bagaimanakah nilai Kp jika suhu dijadikan 950 K?
PEMBAHASAN :
- Jika tekanan diperbesar maka reaksi akan bergeser ke koefisien yang kecil. Reaksi di atas sebelah kiri koefisiennya = 3, sebelah kanan = 3. Wujud solid/padatan tidak dihitung karena tidak mempengaruhi tekanan. Pada reaksi tersebut jika tekanan diperbesar maka tidak akan menggeser kesetimbangan karena jumlah koefisien kiri = kanan. Sehingga jumlah besi akan tetap.
- Jika ditambah Fe2O3 tidak akan menggeser kesetimbangan karena Fe2O3 berwujud padat tidak masuk ke dalam rumusan Kc karena wujud padat tidak mengalami perubahan konsentrasi. Sehingga jumlah besi akan tetap.
- jika suhu dinaikan maka reaksi bergeser ke reaksi endoterm. Di reaksi di atas perubahan entalpi bernilai positif artinya reaksi menuju ke kanan yaitu reaksi endoterm sedangkan reaksi ke kiri merupakan reaksi eksoterm. Jika suhu dinaikan maka reaksi akan bergeser ke reaksi endoterm atau ke kanan menuju pembentukan besi, sehingga besi semakin banyak.
- Jika suhu dari 1.900 K menjadi 950 K atau suhu diturunkan reaksi akan bergeser ke reaksi eksoterm atau menuju ke kiri. Jika reaksi ke kiri sehingga zat di sebelah kiri akan bertambah banyak maka Kp akan berkurang. Karena zat pereaksi akan bertambah banyak
Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
- A + B ⇔ C
- A + C ⇔ 2B
- A ⇔ 2B + C
- A ⇔ 4B + 2C
- 5A ⇔ 8B + 4C
PEMBAHASAN :
Yang menjadi pereaksi adalah A karena mengalami pengurangan konsentrasi sedangkan produk adalah B dan C karena konsentrasinya bertambah
Jika dituliskan dalam reaksi yaitu sebagai berikut
[A] mula-mula = 0,7 M
[A] setimbang = 0,5 M
[B] mula-mula = 0 M
[B] setimbang = 0,8 M
[C] mula-mula = 0 M
[C] setimbang = 0,4 M
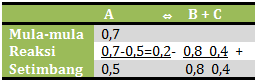
Jika dibandingkan mol pada keadaan reaksi:
mol A : mol B : mol C = 0,2 : 0,8 : 0,4 = 1 : 4 : 2
Perbandingan ini akan sam dengan perbandingan koefisiennya, sehingga:
A ⇔ 4B + 2C
Jawaban D
- 2
- 4
- 6
- 8
- 10
PEMBAHASAN :
Diketahui:Tekanan awal SF6 = 48 torr
Tekanan total = 60 torr

Maka nilai x
P Total = P SF6 + P SF4 + P F2 = 48-x + x + x = 48 + x
60 = 48 + x
x = 12 torr
Maka pada setimbang:
P SF6 = 48 – 12 = 36 torr
P SF4 = P F2 = 12 torr
Sehingga nilai Kp
![]()
Jawaban B
- bergeser ke kiri jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- bergeser ke kanan jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- tidak bergeser jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
- bergeser ke kiri jika ditambahkan 2 mol H2, 2 mol I2 dan 1 mol HI
- tidak bergeser jika ditambahkan 2 mol H2, 2 mol I2 dan 1 mol HI
PEMBAHASAN :
Kita tentukan terlebih dahulu nilai Kc nya sebelum terjadinya penambahan
![]()
Maka setelah penambahan kita akan menghitung Qc (tetapan kesetimbangan sementara)
Pergeseran kesetimbangan akan ditentukan dari perbandingan nilai Qc dan Kc:
- Jika Qc < Kc Maka jumlah produk masih sedikit sehingga reaksi akan bergeser menuju ke produk atau ke kanan
- Jika Qc = Kc artinya sudah setimbang, tidak akan terjadi pergeseran kesetimbangan.
- Jika Qc > Kc Maka jumlah produk terlalu banya sehingga reaksi akan bergeser menuju ke pereaksi atau ke kiri
Karena masing-masing pilihan berbeda penambahannya, maka Qc dihitung sesuai penambahannya masing-masing
- Pilihan A, B, C penambahan 1 mol H2, 1 mol I2 dan 1 mol HI

Karena Qc < Kc maka reaksi akan bergeser ke kanan - Pilihan D, E penambahan 2 mol H2, 2 mol I2 dan 1 mol HI

Karena Qc < Kc maka reaksi akan bergeser ke kanan
Maka jawaban yang tepat adalah B bergeser ke kanan jika ditambahkan 1 mol H2, 1 mol I2 dan 1 mol HI
Jawaban B
- 0,133
- 0,278
- 0,555
- 0,755
- 1,333
PEMBAHASAN :
Kita tentukan nilai m,r,s nya:
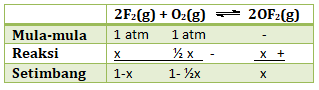
Diketahui P total = 1,75 atm, maka nilai x:
P total = (1-x) + (1-½x) + x
1,75 = 2 – ½x
½x = 0,25
x = 0,5
Maka tekanan parsial masing-masing zat:
P F2 = 1 – x = 1 – 0,5 = 0,5 atm
P O2 = 1 – ½x = 1 – ½.0,5 = 0,75 atm
P OF2 = x = 0,5 atm
Menentukan Kp
![]()
Jawaban E
- 0,10 M
- 0,12 M
- 0,15 M
- 0,20 M
- 0,30 M
PEMBAHASAN :
Kita tentukan nilai Kc sebelum penambahan konsentrasi NH3 dan HCl
![]()
Nilai Kc akan tetap sama jika ditambah NH3 0,4 M dan HCl 0,2 M (karena volume = 1 L, maka mol sama dengan molaritasnya)
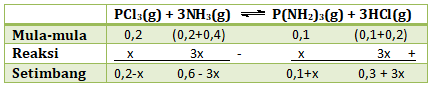
![]()
Kedua sisi di akar 4 kan
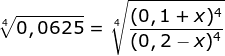
![]()
0,5(0,2 – x) = (0,1 + x)
0,1 – 0,5 x = 0,1 + x
1,5 x = 0
x = 0
Maka konsentrasi P(NH2)3 saat setimbang = 0,1 + x = 0,1 + 0 = 0,1 M
Jawaban A
- untuk meningkatkan hasil reaksi (NH3), maka dapat dilakukan dengan cara menaikkan suhu.
- reaksi pembentukan amonia adalah reaksi eksotermis
- perubahan entalpi reaksi peruraian amonia berharga negatif
- produk peruraian amonia terjadi lebih besar pada suhu rendah
- penambahan katalis akan menaikkan harga tetapan kesetimbangan
PEMBAHASAN :
Dari data di atas jika suhu dinaikan maka nilai Kc dan Kp menjadi lebih kecil. Kita tau bahwa Kc dan Kp berbading lurus dengan jumlah produk dan berbanding terbalik dengan jumlah pereaksi artinya jika Kc atau Kp makin kecil maka jumlah produk menjadi sedikit atau pereaksi bertambah atau dikatakan reaksi sedang bergeser ke kiri (menuju pereaksi) kalau suhu dinaikan. Hal ini disebabkan karena pembentukan amonia bersifat eksoterm. Jika dituliskan persamaan termokimianya.
3H2(g) + N2(g) ![]() 2NH3 (g) ΔH = -x kJ
2NH3 (g) ΔH = -x kJ
Jawaban B
- 3000 atm
- 3100 atm
- 3011 atm
- 3101 atm
- 3111 atm
PEMBAHASAN :
Pada suhu 25 oC reaksi tersebut memiliki Kp = 9 x 105, Maka untuk mengetahui tekanan total sistem kita akan mencari tekanan parsial NH3 dari nilai Kp.
![]()
![]()
(P NH3)2 = 9 x 106
![]()
Maka tekanan totalnya = P NH3 + P N2 + P H2 = 3.000 + 10 + 1 = 3.011 atm
Jawaban C
- tekanan total gas pada keadaan kesetimbangan adalah 80 atm
- setelah tercapai kesetimbangan tekanan parsial gas N2O4 adalah 64 atm
- nilai Kp > 4 pada suhu di atas 400 K
- pada kondisi kesetimbangan tekanan parsial NO2 dua kali tekanan parsial N2O4
PEMBAHASAN :
- Yang diketahui hanya kondisi tekanan mula-mula N2O4, untuk yang reaksi dimisalkan dengan x



288 – 4x = 4x2
4x2 + 4x – 288 = 0
x2 + x – 72 = 0
(x + 9)(x – 8) = 0
x = -9 atau x = + 8
x yang paling mungkin adalah x = +8
Maka saat kesetimbangan
P N2O4 = 72 – x = 72 – 8 = 64 atm
PNO2 = 2x = 2 x 8 = 16 atm
maka P total = PN2O4 + PNO2 = 64 + 16 = 80 atm
BENAR - Sesuai perhitungan no.1 PN2O4 saat setimbang = 64 atm. BENAR
- Reaksi dekomposisi merupakan contoh dari reaksi endoterm. Jika suhu dinaikan di atas 400 K, maka reaksi akan bergeser ke reaksi endoterm atau menuju ke produk. Maka tekanan produk akan bertambah besar dan nilai Kp akan menjadi lebih besar dari 4. BENAR
- Saat setimbang, PNO2 = 16 atm dan PN2O4 = 64 atm, maka PNO2 = 1/4 PN2O4. SALAH
Jawaban A
- 0,2
- 0,5
- 1,0
- 2,0
- 5,0
PEMBAHASAN :
Kita tuliskan keadaaan m,r,s nya
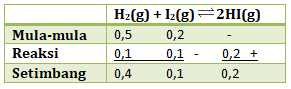
mol H2 dan I2 di reaksi = 0,1 karena perbandingan mol dan koefisien dengan HI
Karena volumenya (V) = 5 L, maka nilai Kc

Jawaban C
- 2,0 x 10-2
- 4,0 x 10-2
- 1,0 x 10-3
- 2,0 x 10-3
- 4,0 x 10-3
PEMBAHASAN :
Rumusan Kp hanya memasukan wujud gas saja. Maka tekanan total berasal dari penjumlahan PNH3 dan PCO2 karena berwujud gas. Maka PNH3 dan PCO2 dari perbandingan koefisien/perbandingan mol.
![]()
![]()
Maka nilai Kp nya
Kp = (PNH3)2. PCO2 = (0,2)2.0,1 = 0,004 = 4 x 10-3
Jawaban E
- Tetapan kesetimbangan
- Kesetimbangan dinamis
- Kesetimbangan homogen
- Kesetimbangan heterogen
- Kesetimbangan tekanan
PEMBAHASAN :
Kesetimbangan dinamis terjadi ketika reaksi berlangsung secara bolak-balik, dengan kecepatan yang sama juga total konsentrasi senyawa tidak mengalami perubahan seiring berjalannya waktu. Reaktan dapat menjadi produk dan produk dapat berubah menjadi reaktan kembali.
Jawaban B
- Tekanan diperbesar
- Volume diperkecil
- Suhu diturunkan
- Suhu dinaikkan
- Konsentrasi NO2 ditambah
PEMBAHASAN :
Jika suhu diturunkan reaksi kesetimbangan bergeser ke kiri dan jika suhu dinaikkan reaksi kesetimbangan bergeser ke kanan.
Jawaban D
- 0,7
- 0,5
- 0,3
- 0,01
- 0,02
PEMBAHASAN :
Diketahui:
[A] = 0,52 M
[B] = 0,65 M
[C] = 0,48 M
Maka tetapan kesetimbangan dapat dihitung sebagai berikut:
![]()
![]()
Kc = 0,7
Jawaban A
- Kesetimbangan bergeser ke arah reaksi yang memiliki koefisien lebih besar, jika volume ditambahkan.
- Kesetimbangan bergeser ke arah reaksi yang memiliki koefisien lebih kecil, jika tekanan diperbesar.
- Kesetimbangan akan bergeser ke arah pembentukkan senyawa-senyawa yang menyerap panas (endoterm), jika suhu dinaikkan.
- Kesetimbangan akan bergeser ke arah berlawanan, jika konsentrasi unsur/ senyawa di salah satu ruas ditambah.
- Kesetimbangan akan bergeser bolak balik bergantung kepada unsur atau senyawa yang direaksikan.
PEMBAHASAN :
Faktor-faktor yang mempengaruhi pergeseran keseimbangan, yaitu:
- Kesetimbangan bergeser ke arah reaksi yang memiliki koefisien lebih besar, jika volume ditambahkan. Sebaliknya jika volume dikurangi maka pergeseran kesetimbangan akan bergeser ke arah reaksi yang memiliki jumlah koefisien lebih kecil.
- Kesetimbangan bergeser ke arah reaksi yang memiliki koefisien lebih kecil, jika tekanan diperbesar. Sebaliknya jika tekanan diperkecil maka kesetimbangan bergeser ke koefisien reaksi besar.
- Kesetimbangan akan bergeser ke arah pembentukkan senyawa-senyawa yang menyerap panas (endoterm), jika suhu dinaikkan. Sebaliknya jika suhu diturunkan maka kesetimbangan akan bergeser ke arah pembentukkan senyawa-senyawa yang melepas panas (eksoterm).
- Kesetimbangan akan bergeser ke arah berlawanan, jika konsentrasi unsur/ senyawa di salah satu ruas ditambah. Sebaliknya jika konsentrasi unsur/senyawa di salah satu ruas dikurangi, maka kesetimbangan akan bergeser ke arah dirinya sendiri.
Jawaban E
Jika pada suhu 300 K, R = 0,082 L atm/mol K, dan reaksi tersebut memiliki Kc = 0,5 mol/L. Maka harga Kp pada suhu 300 K adalah …
- 9,2 atm
- 11,1 atm
- 12,3 atm
- 8,7 atm
- 5,3 atm
PEMBAHASAN :
Diketahui:
T = 300 K
R = 0,082 L atm/mol K
Kc = 0,5 mol/L
nkanan = 2
nkiri = 1
Δn = nkanan – nkiri = 2 – 1 = 1
Maka tetapan kesetimbangan dapat dihitung sebagai berikut:
![]()
Kp = 0,5 mol/L x (0,082L atm/K x 300)1
Kp = 12,3 atm
Jawaban C
Latihan Soal Reaksi Kesetimbangan Kelas XI
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Gimana belajar reaksi kesetimbangannya, kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah. Ok demikian rangkuman materi dan contoh soal reaksi kesetimbangan berikut video pembelajaran dan latihan soalnya. Semoga berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.