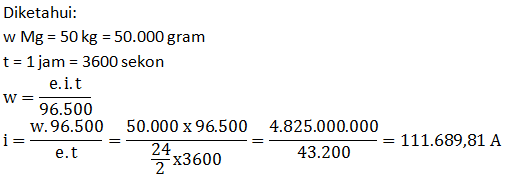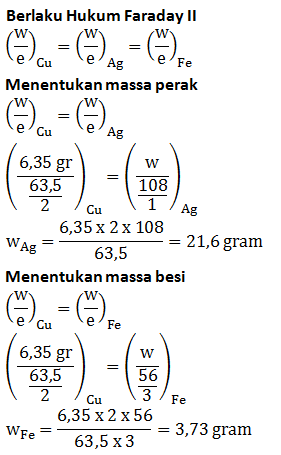Jelaskan perbedaan antara sel elektrokimia dengan sel elektrolisis
PEMBAHASAN :
Elektrokimia memanfaatkanreaksi redoks spontan untuk menghasilkan energi listrik, sedangkan elektrolisis memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan.
PEMBAHASAN :
Karena pada larutan NaCl terdapat air (H2O) yang pada katode lebih mudah mengalami reduksi dibanding ion Na+. Sedangkan pada NaCl cair tidak terdapat air, sehingga yang mengalami reduksi adalah ion Na+
LIHAT JUGA : Rangkuman Materi Elektrolisis
- Lelehan NaCl dielektrolisis dengan elektrode grafit
- Larutan NaCl dielektrolisis dengan elektrode grafit
PEMBAHASAN :
- Elektrolisis Lelehan NaCl dielektrolisis dengan elektrode grafit (inert)
2NaCl(l) → 2Na+(l) + 2Cl–(l)
Katode (-) : 2Na+(l) + 2e– → Na(l)
Anode(+) : 2Cl–(l) → Cl2(g) + 2e– +
2Na+(l) + 2Cl–(l) → Cl2(g) + Na(l) - Elektrolisis Larutan NaCl dielektrolisis dengan elektrode grafit (inert)
2NaCl(aq) → 2Na+(aq) + 2Cl–(aq)
Katode (-) : 2H2O(l) + 2e– → H2(g) + 2OH–(aq)
Anode(+) : 2Cl–(aq) → Cl2(aq) + 2e– +
2H2O(l) + 2Cl–(aq) ® Cl2(g) + H2(g) + 2OH–(aq)
LIHAT JUGA : Video Pembelajaran Elektrolisis
Tuliskan zat-zat yang dihasilkan pada anode dan katode jika larutan H2SO4 encer dielektrolisis dengan elektrode yang terbuat dari tembaga
PEMBAHASAN :
Elektrolisis Larutan H2SO4 dengan elektrode tembaga (non inert/ikut bereaksi)
H2SO4 (aq) → 2H+(aq) + SO42-(aq)
Katode (-) : 2H+(aq) + 2e– → H2(g)
Anode(+) : Cu(s) → Cu2+(aq) + 2e– +
Cu(s) + 2H+(aq) → Cu2+(aq) + H2(g)
LIHAT JUGA : Contoh Soal Elektrolisis Bagian I
- Larutan asam sulfat dengan elektrode karbon
- Larutan CuSO4 dengan elektrode tembaga
- Larutan CuSO4 dengan anode tembaga dan katode besi
- Lelehan NaCl dengan elektrode grafit
- Lelehan Al2O3 dengan elektrode grafit
PEMBAHASAN :
- Elektrolisis Larutan H2SO4 dengan elektrode karbon (inert)
H2SO4 (aq) → 2H+(aq) + SO42-(aq)
Katode (-) : 4H+(aq) + 4e– → 2H2(g)
Anode(+) : 2H2O(l) → 4H+(aq) + 4e– + O2(g) +
2H2O(l) → 2H2(g) + O2(g) - Elektrolisis Larutan CuSO4 dengan elektrode tembaga (non inert)
CuSO4 (aq) → Cu2+(aq) + SO42-(aq)
Katode (-) : Cu2+(aq) + 2e– → Cu(s)
Anode(+) : Cu(s) → Cu2+(aq) + 2e– +
Cu(s) → Cu(s) - Elektrolisis Larutan CuSO4 dengan anode tembaga (non inert) dan katode besi (tidak bereaksi)
CuSO4 (aq) → Cu2+(aq) + SO42-(aq)
Katode (-) : Cu2+(aq) + 2e– → Cu(s)
Anode(+) : Cu(s) → Cu2+(aq) + 2e– +
Cu(s) → Cu(s) - Elektrolisis Lelehan NaCl dielektrolisis dengan elektrode grafit (inert)
2NaCl(l) → 2Na+(l) + 2Cl–(l)
Katode (-) : 2Na+(l) + 2e– → Na(l)
Anode(+) : 2Cl–(l) → Cl2(g) + 2e– +
2Na+(l) + 2Cl–(l) → Cl2(g) + Na(l) - Elektrolisis Lelehan Al2O3 dengan elektrode grafit (inert)
Al2O3(l) → 2Al3+(l) + 3O2-(l)
Katode (-) : 2Al3+(l) + 6e– → 2Al(s)
Anode(+) : 3O2-(l) → 3/2 O2(g) + 2e– +
2Al3+(l) + 3O2-(l) → 2Al(s) + 3/2 O2(g)
- Tuliskan reaksi yang terjadi di anode dan katode
- Hitunglah volume gas yang terjadi di anode dan katode
- Volume gas yang dihasilkan di anode dan katode
- pH larutan setelah elektrolisis (volume larutan dianggap tetap).
- Tuliskan reaksi yang terjadi!
- Berapa lama elektrolisis dilakukan?
- Berapa liter gas yang dihasilkan diukur pada saat 1 gram gas CH4 volumenya 1 liter? (Ar C = 12, H = 1)
- pH larutan setelah elektrolisis jika volume larutan 500 mL.
Sumber Soal : Kimia Kelas XII Pengarang Unggul Sudarmo Penerbit Erlangga