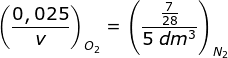Kumpulan Soal Prediksi USBN Kimia SMA Bagian III
3MnO4–(aq)+ 24H+(aq) + 5Fe(s) → 3Mn2+(aq) + 5Fe3+(aq) + 12H2O(I)
Setengah reaksi yang terjadi pada katode adalah …
- MnO4– (aq) + 8H+(aq) + 5e(s) → Mn2+(aq) + 4H2O(I)
- 2MnO4–(aq) + 12H+(aq) + 5e(s) → 2Mn2+(aq) + 3H2O(I)
- Fe(s) → Fe3+(aq) + 3e
- Fe(s) → Fe2+(aq) + 2e
- Fe2+(aq) → Fe3+(aq) + e
PEMBAHASAN :
Reaksi yang terjadi pada katode adalah reaksi penurunan bilangan oksidasi atau reaksi penangkapan elektron dari reaksi redoks di soal diketahui yang mengalami penurunan biloks adalah Atom Mn dari biloks +7 menjadi +2. Jika dituliskan dalam setengah reaksinya menjadi:
MnO4– → Mn2+
Samakan jumlah atom dengan menambahkan H2O
MnO4– → Mn2+ + 4H2O
Samakan atom H dengan menambahkan ion H+
MnO4– + 8H+ → Mn2+ + 2H2O
Samakan muatan dengan menambahkan elektron di muatan yang besar
MnO4– + 8H+ + 5e– → Mn2+ + 2H2O
Jawaban A
Soal No.22
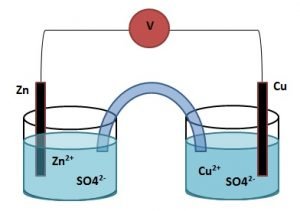
Diagram sel yang paling tepat untuk menggambarkan proses tersebut adalah …
- Zn|Zn2+||Cu2+|Cu
- Zn|Zn2+||Cu2+|SO42-
- Zn2+|SO42-||Cu2+|SO42-
- Cu|Cu2+||Zn2+|Zn
- Cu|CuSO4|| ZnSO4 |Zn
PEMBAHASAN :
Dalam soal tersebut yang ditanyakan adalah notasi sel. Notasi sel merupakan penggambaran secara singkat mengenai sel volta, urutannya:
Anoda | Ion Anoda || Ion Katoda | Katoda
Menentukan anoda dan katoda dapat diketahui dari besar Eo, Eo Zn lebih kecil dibanding Eo Cu. Sehingga yang menjadi anoda adalah Zn sedangkan Cu sebagai katoda. Maka notasi selnya adalah
Zn|Zn2+||Cu2+|Cu
Jawaban A
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.1
- -0,42 Volt
- -1,10 Volt
- +0,42 Volt
- +11,0 Volt
- +1,10 Volt
PEMBAHASAN :
Menentukan Eosel dapat menggunakan rumusan berikut:
Eosel = Eokatoda – Eoanoda = EoCu – EoZn = +0,34 – (-0,76) v = + 1,1 V
Jawaban E
- 0,50 dm3
- 0,56 dm3
- 1,00 dm3
- 2,00 dm3
- 1,12 dm3
PEMBAHASAN :
Soal ini mengenai stoikiometri faraday atau perhitungan elektrolisis berkaitan perbandingan mol zat-zat yang ada dalam reaksi elektrolisis. beberapa langkahnya:
- Tuliskan reaksi elektrolisis:
CuSO4 → Cu2+ + SO42-
Ke katoda (-) ke Anoda (+)
K(-) : Cu2+ + 2e– → Cu
A(+) : 2H2O → 4H+ + 4e– + O2 - Samakan Jumlah elektronnya sehingga reaksinya menjadi:
K(-) : 2Cu2+ + 4e– → 2Cu
A(+) : 2H2O → 4H+ + 4e- + O2 +
2Cu2+ + 2H2O → 4H+ + 2Cu + O2 - Ubah data yang diketahui ke mol
Di soal diketahui massa Cu yang dihasilkan yaitu 3,175 gram, maka mol nya:

- Bandingkan dengan mol O2 (gas yang dihasilkan di anoda) melalui perbandingan dengan koefisien

- Ubah mol O2 ke bentuk volume dengan perbandingan dengan gas N2, pada P dan T yang sama berlaku hukum avogadro:



Jawaban C
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.2
- gugus –OH yang dapat mengoksidasi Fehling
- gugus –CO-yang dapat mereduksi Fehling
- gugus –COOH yang dapat mengoksidasi Fehling
- gugus –CHO yang dapat mereduksi Fehling
- gugus –CHO yang dapat mengoksidasi Fehling
PEMBAHASAN :
Reaksi fehling yang mengandung senyawa CuSO4 yang memiliki ion Cu2+ akan berubah menjadi endapan merah bata karena terbentuk senyawa Cu2O atau mengalami reaksi reduksi dari biloks +2 menjadi +1. Glukosa nya sendiri mengalami oksidasi. Di dalam glukosa terdapat gugus aldehid (-CHO) yang dapat mengalami oksidasi menjadi gugus asam karboksilat. Maka jawaban yang tepat adalah D
Jawaban D
- OH
- –O–
- –CO–
- –COH
- –CO2–
PEMBAHASAN :
Senyawa yang memiliki rumus molekul C2H6O adalah alkohol atau eter. Untuk membedakan alkohol dan eter maka beberapa caranya adalah direaksikan dengan logam Natrium dan PCl3.
- Reaksi Alkohol dengan Na
- R-OH + Na → R-ONa + 1/2 H2
- Reaksi Alkohol dengan PCl3
- R-OH + PCl3 (terbatas) → RCl + H3PO4
- Eter tidak bereaksi baik dengan PCl3 maupun dengan Na
Maka senyawa yang dimaksud mengandung gugus fungsi -OH (Alkohol)
Jawaban A
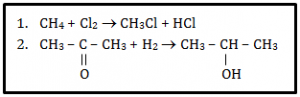
- adisi dan substitusi
- substitusi dan alkilasi
- substitusi dan adisi
- eliminasi dan adisi
- substitusi dan eliminasi
PEMBAHASAN :
Reaksi-reaksi senyawa hidrokarbon dapat ditentukan dengan mudah dengan melihat perubahan ikatan dari kondisi awal menjadi kondisi akhir:
- Substitusi (reaksi pergantian) : tidak terjadi perubahan ikatan. Dari ikatan tunggal tetap menjadi ikatan tunggal.
- Adisi (reaksi penambahan atom atau gugus fungsi) : Terjadi perubahan ikatan dari ikatan rangkap 2 menjadi ikatan tunggal.
- Eliminasi (reaksi penghilangan atom atau gugus fungsi) : terjadi perubahan ikatan dari ikatan tunggal menjadi ikatan rangkap 2.
Reaksi no. 1 tidak tejadi perubahan jenis ikatan. Ikatan tunggal tetap menjadi ikatan tunggal sehingga reaksi no. 1 termasuk reaksi substitusi. Sedangkan pada reaksi no. 2 terjadi perubahan jenis ikatan dari ikatan rangkap 2 menjadi ikatan tunggal sehingga termasuk reaksi adisi. Maka jawaban yang benar adalah C
Jawaban C
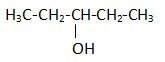
Salah satu dari isomer senyawa tersebut adalah …
- 3-pentanol
- 2-pentanol
- pentanal
- pentanon
- 2-metil-3-butanol
PEMBAHASAN :
Senyawa yang ditanyakan dalam soal adalah senyawa alkohol. Isomer yang ditanyakan bisa isomer rangka (rangka rantai karbonnya saja yang berubah tapi gugus fungsinya berubah) atau bisa jadi isomer posisi (posisi gugus fungsinya yang berubah), atau bisa jadi isomer gugus fungsi (rumus molekulnya sama tapi gugus fungsinya berbeda) isomer gugus fungsi dari alkohol adalah eter. Penjelasan dari tiap pilihan jawaban:
- 3 – pentanol : bukan isomer dari senyawa tersebut karena itu nama senyawa yang ada dalam soal
- 2-pentanol : termasuk isomer posisi karena letak gugus fungsi OH yang berpindah ke no-2
- pentanal : bukan isomer karena bukan isomer gugus fungsinya
- pentanon : bukan isomer karena bukan isomer gugus fungsinya
- 2-metil-3-butanol : Salah penamaan seharusnya 3-metil-2-butanol. Jika namanya betul maka termasuk isomer rangka dan posisi.
Maka jawaban yang paling tepat adalah B
Jawaban B
- 2-klorobutana
- 2-kloro-2-metilbutana
- 1-kloro-2-metilbutana
- 2-kloro-2-butena
- 2-kloro-3-metilbutana
PEMBAHASAN :
2-metil-1-butena jika direaksi dengan HCl maka reaksinya menjadi:
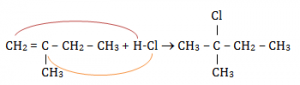
H dan Cl dari HCl akan masuk ke C yang berada di ikatan rangkap. H akan masuk ke C yang memiliki jumlah H yang lebih banyak dan Cl akan masuk ke C yang memiliki H nya lebih sedikit. Sesuai aturan Markovnikoff. Zat yang dihasilkan memiliki nama 2-kloro-2-metilbutana
Jawaban B
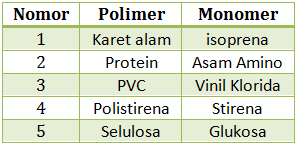
Pasangan polimer yang terbentuk melalui proses adisi adalah …
- 1 dan 2
- 1 dan 3
- 2 dan 3
- 2 dan 5
- 4 dan 5
PEMBAHASAN :
Reaksi adisi pada pembentukan polimer akan dialami oleh monomer yang memiliki ikatan rangkap 2. Monomer pada pilihan jawaban yang memiliki rangkap 2 adalah Isoprena, stirena dan vinil klorida. Sedangkan pembentukan polimer dengan cara kondensasi dicirikan dengan menghasilkan molekul kecil pada produknya. polimer yang mengalami proses pembentukannya melalui kondensasi adalah karbohidrat, protein. Maka jawaban yang paling tepat adalah B
Jawaban B