Kumpulan Soal Ulangan Larutan Penyangga
- 100 ml NH3 0,1 M + 100 ml (NH4)2SO4 0,1 M
- 100 ml H3PO4 0,25 M + 100 ml NaH2PO4 0,25 M
- 100 ml H2SO4 0,05 M + 100 ml KOH 0,05 M
PEMBAHASAN :
- NH3 termasuk ke dalam basa lemah dan (NH4)2SO4 termasuk garam yang mengandung asam konjugasi NH3 yaitu NH4+ maka campuran tersebut termasuk larutan penyangga basa yang tersusun dari basa lemah NH3 dan asam konjugatnya yaitu NH4+
- H3PO4 termasuk ke dalam asam lemah dan NaH2PO4 termasuk garam yang mengandung basa konjugasi H3PO4 yaitu H2PO4- maka campuran tersebut termasuk larutan penyangga asam yang tersusun dari asam lemah H3PO4 dan basa konjugatnya yaitu H2PO4-
- H2SO4 termasuk ke dalam asam kuat dan KOH termasuk basa kuat campuran keduanya tidak akan menghasilkan larutan penyangga. Karena larutan penyangga salah satu komponennya harus berasal dari asam lemah atau basa lemah.
DOWNLOAD KUMPULAN SOAL ULANGAN LARUTAN PENYANGGA DALAM BENTUK PDF KLIK DISINI
PEMBAHASAN :
(NH4)2SO4 merupakan garam yang mengandung asam konjugasi dari NH3 yang merupakan basa lemah. Basa lemah ketika dicampurkan dengan asam konjugasinya maka akan membentuk larutan penyangga basa. Jika diketahui pH larutan penyangga = 8, maka:
pH = 8
pOH = 14 - 8 = 6
[OH-] = 10-6
V basa lemah = 500 mL = 0,5 L
M basa lemah = 0,02 M
Rumus larutan penyangga basa:
valensi adalah jumlah ion asam konjugasinya yaitu NH4+ yaitu 2
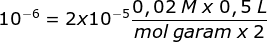
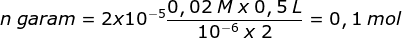
Menentukan massa garam
Mr NH4)2SO4 = Ar N x 2 + Ar H x 8 + Ar S x 1 + Ar O x 4 = 14×2 + 1×8 + 32×1 + 16×4 = 28 + 8 + 32 + 64 = 132
Gr = n x Mr
Gr = 0,1 mol x 132 = 13,2 gram
LIHAT JUGA :
| Latihan Soal Penyangga | Video Penyangga | Tempat Nanya |
| Klik Disini | Klik Disini | Klik Disini |
| Rangkuman Penyangga | Contoh Soal I | |
| Klik Disini | Klik Disini |
- pH larutan tersebut
- pH larutan bila ke dalam larutan tersebut ditambahkan 10 ml larutan NaOH 0,25 M
- pH larutan bila kedalam larutan tersebut ditambahkan 10 ml larutan HCl 0,25 M
- pH larutan bila kedalam larutan tersebut ditambahkan 100 ml air
PEMBAHASAN :
- HCOOH merupakan asam lemah sedangkan HCOONa mengandung HCOO- yang merupakan basa konjugasi dari HCOOH sebagai campuran tersebut akan membentuk larutan penyangga asam. Maka pH campuran tersebut dihitung dengan menggunakan rumus larutan penyangga asam.
Mr HCOOH = Ar H x 2 + Ar C x 1 + Ar O x 2 = 1×2 + 12×1 + 16×2 = 46
Mr HCOONa = Ar H x 1 + Ar C x 1 + Ar O x 2 + Ar Na x 1 = 1×1 + 12×1 + 16×2 + 23×1 = 68
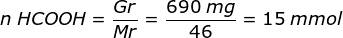

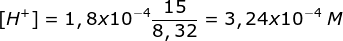
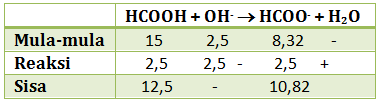
pH = 4 - log 3,24 - Ditambahkan 10 ml NaOH 0,25 M
NaOH akan menghailkan ion OH- yang akan bereaksi dengan HCOOH (asam)
n NaOH = M x V = 0,25 M x 10 ml = 2,5 mmol
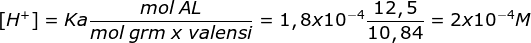
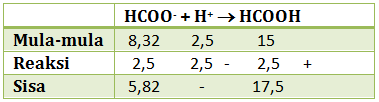
pH = 4 - log 2 - Ditambahkan 10 ml HCl 0,25 M
HCl akan menghailkan ion H+ yang akan bereaksi dengan HCOO- (basa)
n HCl = M x V = 0,25 M x 10 ml = 2,5 mmol
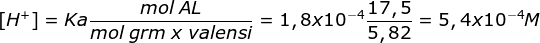
pH = 4 - log 5,4 - Penambahan air atau pengenceran tidak akan mengubah mol asam lemah dan basa konjugatnya. Sehingga nilai pH nya akan sama dengan pH pertama yaitu 4-log 3,24
Campuran yang terdiri dari CH3COOH 0,2 M dan NaOH 0,1 M membentuk 150 ml larutan penyangga dengan pH = 5. Jika Ka CH3COOH = 10-5 tentukan volume masing-masing dari larutan CH3COOH dan NaOH yang digunakan!
PEMBAHASAN :
CH3COOH merupakan asam lemah sedangkan NaOH merupakan basa kuat. Agar membentuk larutan penyangga dengan pH = 5 (penyangga asam), maka basa kuat harus habis (pereaksi pembatas). Jika dimisalkan:
V CH3COOH = V1
V NaOH = 150 - V1 (karena totalnya 150 ml)
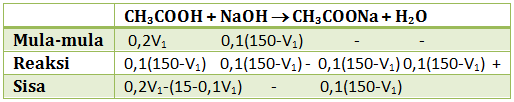
pH = 5
maka [H+] = 10-5
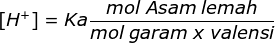
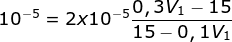
15 - 0,1V1 = 0,6V1 -30
0,7 V1 = 45
V1 = 45/0,7 = 64,285 ml
V CH3COOH = 64,285 ml
V NaOH = 150 - 64,285 ml = 85,714 ml
LIHAT JUGA :
| Latihan Soal Penyangga | Video Penyangga | Tempat Nanya |
| Klik Disini | Klik Disini | Klik Disini |
| Rangkuman Penyangga | Contoh Soal I | |
| Klik Disini | Klik Disini |
