Contoh Soal & Pembahasan Larutan Penyangga/Buffer SBMPTN Kimia SMA
- 1,5
- 4
- 5
- 8,5
- 10
n C6H5OH = M x V = 0,1 M x 30 ml = 3 mmol
n NaOH = M x V = 0,1 M x 15 ml = 1,5 mmol
Jika dituliskan dalam reaksi:

Karena yang bersisa adalah asam lemah dan garamnya, maka hasil reaksinya menghasilkan larutan penyangga asam

Jika diencerkan menjadi 100 ml maka
n C6H5OH menjadi
M1.V1 = M2.V2
n C6H5OH = M2.V2
1,5 mmol = M2.100 ml
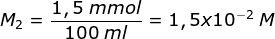
n C6H5O-- menjadi
M1.V1 = M2.V2
n C6H5O-- = M2.V2
1,5 mmol = M2.100 ml
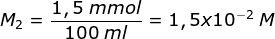
maka setelah pengenceran pH nya menjadi:
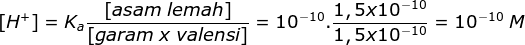
Jawaban E
DOWNLOAD CONTOH SOAL & PEMBAHASAN LARUTAN PENYANGGA/BUFFER SBMPTN DALAM BENTUK PDF KLIK DISINI

- 10-5
- 10-4
- 10-2
- 10-1
- 10
Asam hipobromit yang merupakan asam lemah ketika direaksikan dengan basa konjugasinya (garamnya) maka akan membentuk larutan penyangga asam.
Jika pH = 10, maka nilai [H+] = 10-10, perbandingan

[H+] = Ka x

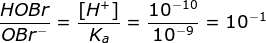
Jawaban D
- 3 + log 2
- 10 - 2 log 2
- 10 - log 2
- 10 + 2 log 2
- 9 + log 2
PEMBAHASAN :
Reaksi antara NaOH dengan HCN
n HCN = 0,15 mol
n NaOH = 0,1 mol
HCN + NaOH → NaCN + H2O
Reaksi 0,1 0,1 - 0,1 0,1 + (NaOH pereaksi pembatas)
Sisa 0,05 - 0,1 0,1
Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
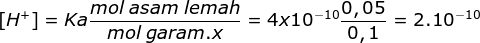
volume diabaikan karena dilakukan pada volume yang sama
pH = 10 - log 2
Jawaban C
- 4 + log 5
- 6 - log 2
- 6 + log 2
- 8 - log 2
- 10 + log 5
PEMBAHASAN :
Reaksi antara asam hipoklorit (HClO) dengan NaOH
n HClO = M x V = 100 mL x 0,1 M = 10 mmol
n NaOH = M x V = 100 mL x 0,05 M = 5 mmol
HClO + NaOH → NaClO + H2O
Reaksi 5 5 - 5 5 + (NaOH pereaksi pembatas)
Sisa 5 - 5 5
Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
pH = 8 - log 2
Jawaban D
- 2
- 4
- 10 - log 5
- 10
- 12
PEMBAHASAN :
Reaksi antara HCN dengan KOH
n HCN = M x V = 0,30 M x 200 mL = 60 mmol
n KOH = M x V = 0,30 M x 100 mL = 30 mmol
HCN + KOH → KCN + H2O
Mula-mula 60 30 - -
Reaksi 30 30 - 30 30 + (KOH pereaksi pembatas)
Sisa 30 - 30 30
Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam.
Ketika di tambah 0,8 gr NaOH pada campuran maka OH-- dari NaOH akan bereaksi dengan HCN membentuk CN--
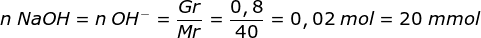
HCN + OH-- → CN-- + H2O
Reaksi 20 20 - 20 20 + (OH- pereaksi pembatas)
Sisa 10 -- 50 50
pH = 10
Jawaban D
- 2
- 3
- 4
- 5
- 6
PEMBAHASAN :
Reaksi antara CH3COOH dengan NaOH
n CH3COOH = 0,6 mol
n NaOH = 0,2 mol
CH3COOH + NaOH → CH3COONa + H2O
Reaksi 0,2 0,2 - 0,2 0,2 + (NaOH pereaksi pembatas)
Sisa 0,4 -- 0,2 0,2
Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
volume diabaikan karena dilakukan pada volume yang sama
pH = 4
Jawaban C
- 2 x 10-10 M
- 2 x 10-7 M
- 2 x 10-6 M
- 5 x 10-5 M
- 7 x 10-4 M
- buffer dengan pH 5
- buffer dengan pH 6
- buffer dengan pH 9
- garam terhidrolisis dengan pH 5
- basa dengan pH 9
PEMBAHASAN :
Reaksi antara asam hipoklorit (HClO) dengan NaOH
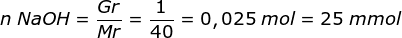
n CH3COOH = M x V = 0,1 M x 500 mL = 50 mmol
CH3COOH + NaOH → CH3COONa + H2O
Reaksi 25 25 - 25 25 + (NaOH pereaksi pembatas)
Sisa 25 -- 25 25
Karena yang bersisa adalah asam lemah dan garamnya maka akan membentuk larutan penyangga asam. Menentukan pH nya dengan rumus penyangga asam
pH = 5
Jawaban A
- 5 - log 3,6
- 5 - log 3,2
- 4 - log 7,2
- 4 - log 3,6
- 4 - log 1,8
n HCOOH = M x V = 0,01 M x 100 mL = 1 mmol
n HCOONa = M x V = 0,005 M x 100 mL = 0,5 mmol
Jika ditambahkan air sampai volume 200 mL, maka molaritas zat menjadi

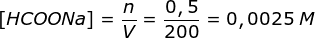
Karena terdiri dari asam lemah dan garamnya maka akan terbentuk larutan penyangga asam
Menentukan pH nya dengan rumus penyangga asam
pH = 4 - log 3,6
Jawaban D
- 50 mL CH3COOH 0,2 M dan 50 mL NaOH 0,1 M
- 50 mL CH3COOH 0,2 M dan 100 mL NaOH 0,1 M
- 50 mL HCl 0,2 M dan 100 mL NH3 (aq) 0,1 M
- 50 mL HCl 0,2 M dan 50 mL NH3 (aq) 0,1 M
- 50 mL HCl 0,2 M dan 50 mL NaOH 0,1 M
Jika akan membentuk larutan penyangga maka mol asam lemah atau basa lemah harus lebih besar dibanding basa kuat atau asam kuatnya. Pada pilihan A mol CH3COOH (asam lemah) = 0,2 M x 50 mL = 10 mmol lebih besar dibandingkan mol NaOH (basa kuat) = 0,1 M x 50 mL = 5 mmol. Sehingga yang bersisa nanti adalah asam lemah dengan garamnya yang akan membentuk larutan penyangga asam
Jawaban A
DOWNLOAD CONTOH SOAL & PEMBAHASAN LARUTAN PENYANGGA/BUFFER SBMPTN DALAM BENTUK PDF KLIK DISINI


