Kumpulan Soal Ulangan Larutan Elektrolit & Non Elektrolit
PEMBAHASAN :
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik sedangkan larutan non elektrolit larutan yang tidak dapat menghantarkan listrik. Larutan elektrolit dapat menghantarkan listrik karena dalam larutannya terdapat ion-ion yang dapat melepaskan elektron dan menangkap elektron sehingga elektron dapat mengalir diantara dua kutub.
DOWNLOAD KUMPULAN SOAL ULANGAN ELEKTROLIT DALAM BENTUK PDF KLIK DISINI
PEMBAHASAN :
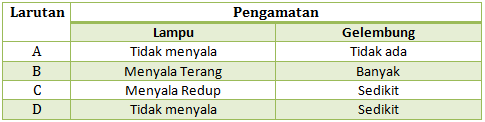
Hasil daya hantar listrik beberapa larutan dalam uji daya hantar listrik:
- Larutan elektrolit kuat : lampu menyala terang, gelembung banyak.
- Larutan elektrolit lemah : lampu menyala redup/tidak menyala, gelembung sedikit.
- Larutan non elektrolit : lampu tidak menyala, gelembung tidak ada.
Dari ciri-ciri di atas, maka
- Larutan A : larutan non elektrolit
- Larutan B : larutan elektrolit kuat
- Larutan C : larutan elektrolit lemah
- Larutan D : larutan elektrolit lemah
PEMBAHASAN :
- larutan BaSO4 merupakan garam yang termasuk ke dalam larutan elektrolit kuat
- Larutan AgOH merupakan basa lemah yang termasuk kedalam elektrolit lemah
- Larutan C12H22O11 (sukrosa/gula putih) merupakan larutan non elektrolit
Berdasarkan ciri-ciri larutan elektrolit dan non elektrolit pada soal no 2, maka:
- Larutan BaSO4 lampu menyala terang, gelembung banyak.
- Larutan AgOH lampu menyala redup, gelembung sedikit
- Larutan C12H22O11 lampu mati, tidak ada gelembung.
Tuliskan reaksi ionisasi dari larutan berikut:
a.Ca(NO3)2
b.Zn(OH)2
c.CO(NH2)2
PEMBAHASAN :
a. Ca(NO3)2 → Ca2+ + 2NO3-
b. Zn(OH)2 → Zn2+ + 2OH-
c. CO(NH2)2 → CO(NH2)2 (tidak mengalami ionisasi)
- HBr 0,1 M
- H2SO4 0,1 M
- NH3 0,1 M
- C2H5OH
PEMBAHASAN :
HBr dan H2SO4 merupakan larutan elektrolit kuat, NH3 merupakan larutan elektrolit lemah sedangkan C2H5OH merupakan larutan non elektrolit. HBr dan H2SO4 keduanya merupakan elektrolit kuat dengan molaritas yang sama. H2SO4 lebih kuat elektrolitnya karena mengandung ion yang lebih banyak.
H2SO4 → 2H+ + SO42- (3 ion)
HBr → H+ + Br- (2 ion)
PEMBAHASAN :
Garam dapur (NaCl) merupakan senyawa ion yang termasuk larutan elektrolit kuat. Senyawa ion jika dalam bentuk padat belum memiliki ion-ion yang bergerak bebas. Sedangkan dalam bentuk cair dan larutannnya NaCl sudah memiliki ion-ion yang dapat menghantarkan listrik
- NH4NO3
- H2O2
- N2O3
- MnO42-
- PO43-
PEMBAHASAN :
- NH4NO3, senyawa harus dibagi dua dulu, sesuai ion yang terbentuk
NH4NO3 → NH4+ + NO3-
Menentukan b.o N dalam NH4+
b.o N x 1 + b.o H x 4 = +1
b.o N + (1) x 4 = +1
b.o N = -3
Menentukan b.o N dalam NO3-
b.o N x 1 + b.o O x 3 = -1
b.o N + (-2) x 3 = -1
b.o N = +5 - H2O2
b.o H x 2 + b.o O x 2 = 0
(+1) x 2 + b.o O x 2 = 0 (masukan pertama kali b.o H karena prioritas lebih tinggi
2b.o O = -2
b.o O = -1 - N2O3
b.o N x 2 + b.o O x 3 = 0
b.o N x 2 + (-2) x 3 = 0
b.o N x 2 - 6 = 0
2b.o N = +6
b.o N = +3 - MnO42-
b.o Mn x 1 + b.o O x 4 = -2
b.o Mn + (-2) x 4 = -2
b.o Mn - 8 = -2
b.o Mn = +6 - PO43-
b.o P x 1 + b.o O x 4 = -3
b.o P + (-2) x 4 = -3
b.o P - 8 = -3
b.o P = +5
- MnO2 mengalami penurunan biloks sehingga mengalami reaksi reduksi atau sebagai OKSIDATOR
- HCl mengalami kenaikan biloks sehingga mengalami reaksi oksidasi atau sebagai REDUKTOR
- hasil oksidasi adalah zat di produk akibat mengalami reaksi oksidasi yaitu Cl2
- hasil reduksi adalah zat di produk akibat mengalami reaksi reduksi yaitu MnCl2
PEMBAHASAN :
PEMBAHASAN :
- P2O5 termasuk senyawa kovalen karena tersusun dari non logam dan non logam, maka dalam tata nama harus menyebutkan jumlah atomnya. Sehingga namanya adalah Diposfor pentaoksida
- Na2O termasuk senyawa ion karena tersusun dari logam dan non logam. Logamnya hanya memiliki 1 biloks sehingga tidak perlu disebutkan biloksnya. Penamaannya tanpa perlu menyebut jumlah atomnya. Sehingga namanya menjadi Natrium oksida
- CuBr2 termasuk senyawa ion karena tersusun dari logam dan non logam. Logamnya memiliki lebih dari 1 biloks sehingga perlu disebutkan biloksnya dalam bentuk angka romawi. Biloks dari Cu dalam senyawa CuBr2 adalah +2. Penamaannya tanpa perlu menyebut jumlah atomnya. Sehingga namanya menjadi Tembaga (II) bromida
- (NH4)2SO4 disebut juga senyawa poliatomik karena tersusun dari beberapa atom. Senyawa tersebut tersusun dari ion NH4+ yang memiliki nama ion amonium dan ion SO42- yang memiliki nama sulfat. Jadi namanya cukup menggabungkan nama kation dan anionnya yaitu amonium sulfat
DOWNLOAD KUMPULAN SOAL ULANGAN ELEKTROLIT DALAM BENTUK PDF KLIK DISINI