Contoh Soal & Pembahasan Hidrolisis SBMPTN Kimia SMA
- 9,5
- 10,0
- 11,5
- 12,5
- 13,0
HCN merupakan asam lemah dan KOH merupakan basa kuat. Jika ada asam dan basa maka reaksikan terlebih dahulu.
Menentukan mol HCN
n = M x V = 0,1 M x 200 mL = 0,1 M x 0,2 L= 0,02 mol
Menentukan mol KOH


Karena kedua pereaksi habis maka termasuk hidrolisis yang ditinjau adalah garam. Garam yang di hasilkan dari reaksi HCN dan KOH akan bersifat basa karena terbentuk dari basa kuat dan asam lemah (hidrolisis lihat siapa yang kuat)
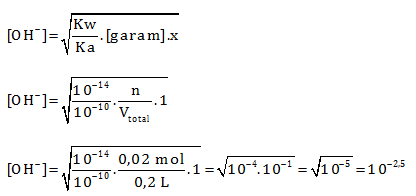
pOH = 2,5
pH = 14 – 2,5 = 11,5
Jawaban C
DOWNLOAD CONTOH SOAL & PEMBAHASAN HIDROLISIS SBMPTN DALAM BENTUK PDF KLIK DISINI
- 4 - log 2
- 5 - log 4
- 10 + log 2
- 10 - log 2
- 10 + log 4
KClO merupakan garam yang terbentuk dari KOH(Basa kuat) dan HClO (asam lemah), maka sifat garamnya bisa dilihat dari yang kuat yaitu basa. Maka pH nya dapat ditentukan dengan rumus

pOH = 4 - log 2
pH = 14 - (4 - log 2) = 10 + log 2
Jawaban C
- 4 - log 2
- 6 + log 4
- 6 - log 2
- 8 + log 2
- 8 - log 4
NH4Cl merupakan garam yang terbentuk dari NH4OH(basa lemah) dan HCl (asam kuat), maka sifat garamnya bisa dilihat dari yang kuat yaitu asam. Maka pH nya dapat ditentukan dengan rumus
[H+] = 2. 10-6
pH = 6 - log 2
Jawaban C
- 9 - log 5
- 8 + log 5
- 8 - log 5
- 6 + log 5
- 6 - log 5
Menentukan mol NH3 dan HCl sebelum direaksikan
n NH3 = M x V = 0,1 M x 250 mL = 25 mmol (NH3 dan H2O jika direaksikan menjadi NH4OH)
n HCl = M x V = 0,1 M x 250 mL = 25 mmol
Maka jika direaksikan
reaksi 25 25 - 25 25 +
Sisa -- - 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.
Maka pH nya dapat ditentukan dengan rumus
[H+] = 5. 10-6
pH = 6 - log 5
Jawaban E
- pH larutan asam sebelum titrasi adalah 3
- pH larutan asam setelah titrasi lebih besar dari 7
- CH3COONa hasil reaksi mengalami hidrolisis
- Konsentrasi Na+ dalam campuran 0,05 M
- pH larutan asam sebelum titrasi adalah 3
CH3COOH merupakan asam lemah, sehingga menentukan pH menggunakan rumusan
pH = 3
BENAR - pH larutan asam setelah titrasi lebih besar dari 7
Karena garam yang dihasilkan CH3COONa terbentuk dari CH3COOH (asam lemah) dan NaOH (basa kuat), sifat garamnya bisa dilihat dari yang kuat yaitu basa atau pH > 7
BENAR - CH3COONa hasil reaksi mengalami hidrolisis
Reaksi CH3COONa dengan air setelah sebelumnya terionisasi
CH3COONa → CH3COO-- + Na+
……………………..basa kuat asam lemah (yang bereaksi hanya CH3COO-)
CH3COO-- + H2O → CH3COOH + H+
Na+ + H2O → tidak bereaksi
Mengalami hidrolisis parsial/sebagian
BENAR - Konsentrasi Na+ dalam campuran 0,05 M
Menentukan mol CH3COOH dan NaOH sebelum direaksikann NH3 = M x V = 0,1 M x 25 mL = 2,5 mmol
n NaOH = M x V = 0,1 M x 25 mL = 2,5 mmol
Maka jika direaksikanCH3COOH + NaOH → CH3COONa + H2O
mula-mula 2,5 2,5 -- -
reaksi 2,5 2,5 - 2,5 2,5 +
Sisa - -- 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.
CH3COONa → CH3COO-- + Na+
0,05 M 0,05M
BENAR
Jawaban E
- CH3COONa
- CH3COONH4
- Al2(SO4)3
- NH4CN
- Na2SO4
Larutan garam yang mengubah lakmus merah menjadi biru adalah garam basa yaitu yang terbentuk dari basa kuat dan asam lemah yaitu pilihan A CH3COONa dari CH3COOH (asam lemah) dan NaOH (basa kuat)
Jawaban A
- NH4CN
- CH3COONa
- KNO3
- NH4NO3
Larutan garam yang mempunyai pH < 7 adalah garam basa yaitu yang terbentuk dari asam kuat dan basa lemah yaitu pilihan 4 saja NH4NO3 dari NH4OH (basa lemah) dan HNO3 (asam kuat)
Jawaban D
Larutan NaCl terhidrolisis sempurna menjadi NaOH dan HCl
SEBAB
Kesetimbangan ionisasi terjadi pada larutan asam dan basa lemah
Larutan NaCl jika terionisasi akan terurai menjadi
NaCl(aq) → Na+(aq) + Cl--(aq)
Jawaban D
PEMBAHASAN :
- Konsentrasi larutan NaCN menjadi 0,1 M
Menentukan molaritas setelah pengenceran, menggunakan rumus:
M1.V1 = M2.V2
0,2 M. 50 mL = M2. 100 mL
M2 = 10/100 = 0,1 M
BENAR - Larutan terhidrolisis dengan reaksi
CN-- + H2O
NaCN mengalami ionisasi
NaCN → Na+ + CN-
………..asam lemah basa kuat
Na+ + H2O → tidak bereaksi
CN-- + H2O → HCN + OH--
BENAR - Konstanta reaksi hidrolisis =

Reaksi hidrolisisnya
CN-- + H2O → HCN + OH--
Maka konstanta reaksi hidrolisisnya
Kh =
BENAR - pH larutan = 11
NaCN berasal dari NaOH (basa kuat) dan HCN (asam lemah), maka garamnya bersifat basa
pOH = 3
pH = 14 - 3 = 11
BENAR
Jawaban E
- Natrium asetat
- Ammonium asetat
- Ammonium klorida
- Natrium klorida
Hidrolisis parsial terjadi pada garam yang terbentuk pada asam lemah dengan basa kuat atau garam dari basa lemah dengan asam kuat. Yang termasuk garam yang terhidrolisis parsial adalah pilihan no 1 dan 3. Natrium asetat (CH3COONa) berasal dari CH3COOH (asam lemah) dan NaOH (basa kuat) yang mengalami hidrolisis hanya ion CH3COO--. Sedangkan Ammonium klorida (NH4Cl) berasal dari NH4OH (basa lemah) dan HCl (Asam kuat) yang mengalami hidrolisis hanya ion NH4+
Jawaban B
DOWNLOAD CONTOH SOAL & PEMBAHASAN HIDROLISIS SBMPTN DALAM BENTUK PDF KLIK DISINI

