Contoh Soal & Pembahasan Sel Volta Bagian I
Diketahui potensial elektrode perak dan tembaga sebagai berikut
Ag+ + e → Ag Eo = +0.80 V
Cu2+ + 2e → Cu Eo = +0.34 V
a. Tulislah diagram sel volta yang dapat disusun dari kedua elektrode tersebut
b. Tentukan potensial standar sel itu
c. Tuliskan pula reaksi selnya
Katoda = Ag (E0 lebih besar)
Anoda = Cu (E0 lebih kecil)
a. Diagram selnya: Cu|Cu2+||Ag+|Ag
b. Eosel = E0katoda – E0anoda
Reaksi Sel (Redoks) : Cu + 2Ag+ → Cu2+ + 2Ag Eosel = 0,46 v
Zn2+ + 2e → Zn Eo = -0,76 V
Cu2+ + 2e → Cu Eo = +0.34 V
Al3+ + 3e → Al Eo = -1,66 V
a. Tulislah diagram sel volta yang dapat disusun dari ketiga elektrode tersebut
b. Tentukan potensial standar masing-masing sel itu
c. Tuliskan pula reaksi selnya
a. diagram sel volta hanya bisa dibuat dari dua elektrode, sehingga ada 3 diagram sel volta :
LIHAT JUGA : Rangkuman Materi Sel Volta
Fe + Cu2+→ Fe2+ + Cu
Gambarlah rangkaian sel volta yang berdasarkan reaksi tersebut.Tulislah juga diagram (notasi) sel volta itu.
Rangkaian sel volta
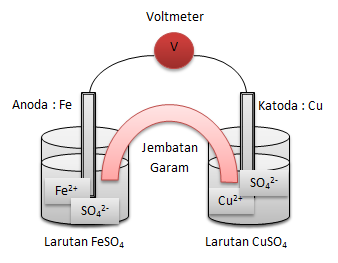
Notasi selnya:
Fe | Fe2+ || Cu2+ | Cu
LIHAT JUGA : Video Pembelajaran Sel Volta
2Al + 6H+→ 2Al3+ + 3H2
Gambarlah rangkaian sel volta yang berdasarkan reaksi tersebut.Tulislah juga diagram (notasi) sel volta itu.
Rangkaian sel volta
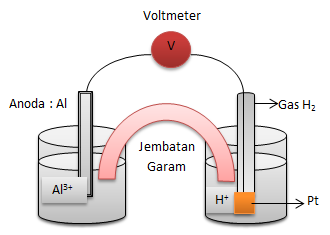
Notasi selnya:
Al | Al3+ || H+ | H2 | Pt
LIHAT JUGA : Contoh Soal Sel Volta Bagian II
a. Ni | Ni2+ || Ag+ | Ag
b. Pt | H2 | H+ || Ce4+ , Ce3+ | Pt
a. Reaksi elektrode
Apa artinya jika suatu elektrode mempunyai potensial standar bertanda negatif
Potensial elektrode standar merupakan potensial sel yang dihasilkan oleh suatu elektrode dengan elektrode hidrogen yang dilakukan pada kondisi standar, yaitu pada suhu 25 oC dengan konsentrasi ion-ion 1 M dan tekanan gas 1 atm. Jika suatu elektrode mempunyai potensial standar bertanda negatif artinya elektrode tersebut lebih sukar mengalami reduksi dibandingkan elektrode hidrogen
Zn2+ + 2e → Zn Eo = -0,76 V
Ag+ + e → Ag Eo = +0.80 V
a. Logam manakah yang lebih mudah mengalami oksidasi, Zn atau Ag? Jelaskan.
b. Ion manakah yang lebih mudah mengalami reduksi, Zn2+ atau Ag+? Jelaskan
a. logam yang mudah mengalami oksidasi yaitu logam Zn dengan nilai Eo lebih besar saat mengalami oksidasi (Nilai Eo dibalik)
b. ion yang mudah menglami reduksi yaitu Ag+ Karena memiliki nilai Eo lebih besar saat mengalami reduksi
a. Zn2+ + 2e → Zn Eo = -0,76 V
a. notasi sel : Zn | Zn2+ || Ni2+ | Ni
Eosel = +0,80 v – (+0,34 v) = +0,46 v
Ag+ + e → Ag Eo = +0.80 V
Sn2+ + 2e → Sn Eo = -0,14 V
Cu2+ + 2e → Cu Eo = +0.34 V
Cr3+ + 3e → Cr Eo = -0,74 V
Fe2+ + 2e → Fe Eo = -0,44 V
a. Pilihlah 2 pasangan setengah sel yang mempunyai nilai Eo paling tinggi
b. Buatlah diagram sel dari reaksi tersebut
a. Untuk mencari pasangan dengan nilai Eosel paling tinggi cari Eo yang paling besar sebagai katoda dan Eo paling kecil sebagai
b. Diagram selnya : Cr | Cr3+ || Ag+ | Ag
2Al + 3Zn2+ → 2Al3+ + 3Zn Eo = +0,9 V
Zn + Cu2+ → Zn2+ + Cu Eo = +1,1 V
Fe + Zn2+ → Fe2+ + Zn Eo = -0,22 V
a. Urutkanlah logam-logam Al,Zn, Cu, dan Fe berdasarkan bertambahnya daya pereduksi, dari pereduksi paling lemah hingga yang
Jika Dianggap tidak diketahui Eomasing-masing elektrode
a. sel I : Eosel = EoZn – EoAl= +0,9 v
c. notasi sel volta dengan potensial terbesar yaitu antara logam dengan Eo terbesar yaitu Cu dengan logan dengan Eo terkecil yaitu Al notasinya : Al | Al3+ || Cu2+ | Cu
Fe3+ + 2e → Fe2+ Eo = +0,77 V
Cu2+ + 2e → Cu Eo = +0.34 V
Fe2+ + 2e → Fe Eo = -0,44 V
Periksalah apakah reaksi berikut dapat atau tidak berlangsung spontan
a. Cu + 2Fe3+ → 2Fe2+ + Cu2+
b. Cu + Fe2+ → Fe + Cu2+
a. Eosel = EoFe2+ – EoCu
Karena Eosel bernilai negatif (-) maka reaksi berlangsung tidak spontan
Al3+ + 3e → Al Eo = -1,66 V
Cu2+ + 2e → Cu Eo = +0.34 V
Periksalah apakah larutan CuSO4 dapat disimpan dalam bejana yang terbuat dari bahan alumunium
PEMBAHASAN :
Larutan CuSO4 tidak dapat disimpan dalam bejana dari bahan alumunium, karena alumunium dapar mereduksi tembaga sehingga akan mengendapkan tembaga dari larutannya. Hal ini disebabkan karena alumunium lebih mudah mengalami oksidasi karena nilai Eo lebih kecil dibanding tembaga, sesuai reaksi:
2Al(s) + 3CuSO4(aq) → Al2(SO4)3(aq) + 3Cu(s)
a. Cd + Ni2+ → Cd2+ + Ni
b. Zn + Pb2+ → Zn2+ + Pb
a. Rangkaian Sel Volta
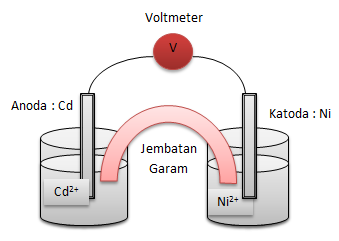
diagram selnya : Cd | Cd2+ || Ni2+ | Ni
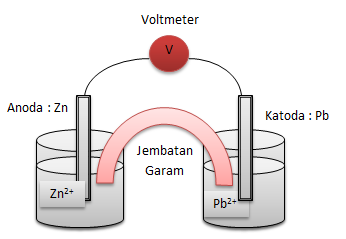
diagram selnya : Zn | Zn2+ || Pb2+ | Pb
Sn | Sn2+ || Hg2+ | Hg
PEMBAHASAN :
Reaksi elektrode
Anoda : Sn → Sn2+ + 2e
Katoda : Hg2+ + 2e → Hg +
Reaksi Sel : Sn + Hg2+ → Sn2+ + Hg
Zn2+ + 2e → Zn Eo = -0,76 V
Al3+ + 3e → Al Eo = -1,66 V
PEMBAHASAN :
Zn2+ + 2e → Zn Eo = -0,76 V (x3)
Al → Al3+ + 3e Eo = +1,66 V (x2) +
Reaksi Sel : 2Al + 3Zn2+ → 2Al3+ + 3Zn Eosel = +0,90 v
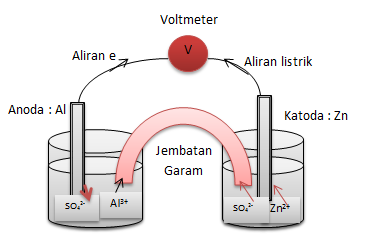
a. Reaksi pada katode dan anode
b. Arah aliran elektron dan arah aliran listriknya.
c. Arah kation dan anion pada jembatan garam.
a. Reaksi pada katode : Zn2+ + 2e → Zn
c. Arah aliran kation dan anion pada jembatan garam
2V2+ + Sn4+→ 2V3+ + Sn2+ dengan Eo V3+ = -0,256 V dan Eo Sn4+ = +0,154 V
Gambarlah rangkaian sel volta yang berdasarkan reaksi tersebut.Tulislah juga diagram (notasi) sel volta itu.
Rangkaian sel volta
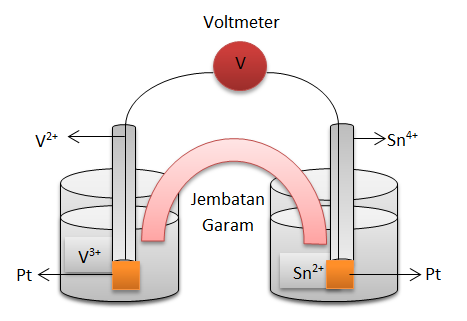
Notasi selnya:
Pt | V2+ | V3+ || Sn4+ | Sn2+ | Pt
Sumber Soal : Kimia Kelas XII Pengarang Michael Purba & Sunardi Penerbit Erlangga

Terima kasih sebanyak banyaknya
Suksessss!!!!😊😊
Sama-sama, amiin. Bantu share juga yah
Makasih banget, bantu banget. Aku sering banget mampir kesini, terutama ke web bagian fisika heheuw.. Tertolong banget astaga 😭😭👍
Sama-sama. bantu share juga ya ke temen2 kamu biar pada tau
Mksh bngt kak ngbantu banget.
Artikel yang sangat bermanfaat