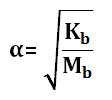Halo selamat datang di semester 2. Bab awal kimia semester 2 untuk kelas 11 adalah asam basa. Di SMP mungkin kalian sudah belajar sedikit mengenai asam basa kali ini kita mau bantu kamu dengan membuat rangkuman materi dan contoh soal asam basa dan titrasi. Kumpulan pertanyaan tentang asam dan basa berikut pembahasan asam basa. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini dan terakhir coba latihan soal asam basa yah. Selamat belajar
DAFTAR ISI
Rangkuman Materi Teori Asam Basa, Menghitung pH, Titrasi
Teori Asam Basa
Teori Arhenius
HCl(aq) ® H+ (aq) + Cl–(aq)
KOH (aq) ® K+(aq) + OH(aq)
Teori Bronsted-Lowry
Asam : Zat yang bertindak sebagai donor/pemberi proton (H+)
Basa : Zat yang bertindak sebagai akseptor/penerima proton (H+)
Teori Lewis
Asam : Zat yang bertindak sebagai akseptor/penerima pasangan elektron
Basa : Zat yang bertindak sebagai donor/pemberi pasangan elektron
Contoh:
NH3(g) + BF3(g) ® H3N–BF3(s)
Dalam reaksi tersebut, BF3 bertindak sebagai akspetor pasangan elektron
Asam
Terbagi menjadi dua:
Asam Kuat
Mengalami ionisasi sempurna dalam air
Memiliki derajat ionisasi (α) = 1
Contohnya: H2SO4, HCl, HBr, HI, HNO3, HClO4
Rumus penentuan pH:
[H+] = a. Ma
Ket : a = valensi asam (jumlah H+)
Ma = Molaritas Asam
pH = – log [H+]
Jika [H+] = 10-a maka pH = a
Jika [H+] = b. 10-a maka pH = a – log b
Asam Lemah
Mengalami ionisasi sebagian dalam air
Memiliki derajat ionisasi 0<α<1, rumus menentukan α: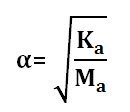
Contohnya : HCN, HF, H3PO4, CH3COOH, dll
Rumus penentuan pH:
pH = – log [H+]
Jika [H+] = 10-a maka pH = a
Jika [H+] = b. 10-a maka pH = a – log b
BASA
Basa Kuat
Mengalami ionisasi sempurna dalam air
Memiliki derajat ionisasi (α) = 1
Contohnya : LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2
Rumus penentuan pH:
[OH–] = b. Mb
Ket : b = valensi basa(jumlah OH–)
Mb = Molaritas Basa
pOH = – log [OH–]
Jika [OH–] = 10-a maka pOH = a
Jika [OH–] = b. 10-a maka pOH = a – log b
pH = 14 – pOH
Basa Lemah
Mengalami ionisasi sebagian dalam air
Memiliki derajat ionisasi 0<α<1, rumus menentukan α :
Contohnya : NH4OH, AgOH, Fe(OH)2, Fe(OH)3, Mg(OH)2,dll
Rumus penentuan pH:
pOH = – log [OH–]
Jika [OH–] = 10-a maka pOH = a
Jika [OH–] = b. 10-a maka pOH = a – log b
pH = 14 – pOH
TITRASI
- Merupakan metode analisis kuantitatif untuk menentukan kadar suatu larutan.
- Jika zat yang akan ditentukan kadarnya adalah larutan asam maka harus dititrasi oleh larutan basa, begitu pula sebaliknya.
Perhitungan Titrasi
- Perhitungan titrasi berguna menentukan konsentrasi larutan asam / basa yang diperolehdari hasil titrasi pada keadaan titik ekuivalen.
- Titik ekuivalen terjadi pada saat asam tepat bereaksi dengan basa, dan sebaliknya.Berlaku hubungan:
Jumlah gram ekuivalen (grek) asam = Jumlah gram ekuivalen (grek) basa
Dengan :
Jumlah grek asam = Va x Na
Jumlah grek basa = Vb x Nb
Na = Normalitas Asam (N), Va = Volume asam (L)
Nb = Normalitas Basa (N), Vb = Volume basa (L)
- Sehingga berlaku hubungan:
Va x Na = Vb x Nb
- Hubungan normalitas dan molaritas
Na = Ma x a
Nb = Mb x b
- Sehingga berlaku hubungan:
Va x Ma x a = Vb x Mb x b
Dengan :
Ma = molaritas asam;
a = valensi asam/jumlah ion H+
Mb = molaritas basa;
b = valensi basa/jumlah ion OH–
Contoh Soal Asam Basa dan Titrasi dan Pembahasannya
PEMBAHASAN :
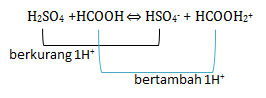
Pasangan asam- basa konjugasi adalah teori yang di cetuskan oleh Bronsted-Lowry. Dimana asam adalah zat yang memberikan/donor proton(H+) sehingga di akhir akan berkurang 1 H+. Sedangkan basa adalah penerima/akseptor proton(H+) sehingga di akhir akan bertambah 1H+. Jika dilihat dari reaksinya:
H2SO4 berkurang 1H+ menjadi HSO4– sehingga H2SO4 bersifat asam sedangkan HSO4– akan bersifat basa atau menjadi basa konjugasi
HCOOH bertambah 1H+ menjadi HCOOH2+ sehingga HCOOH bersifat basa sedangkan HCOOH2+ akan bersifat asam atau menjadi asam konjugasi
Maka pasangan asam-basa konjugasinya adalah H2SO4 – HSO4–
Soal No.2
PEMBAHASAN :
Mr H2SO4 = (1 x 2 + 32 x 1 + 16 x 4) = 98
Menentukan molaritas H2SO4
![]()
Menentukan pH
Karena H2SO4 merupakan asam kuat maka rumusannya:
[H+] = a. Ma = 2. 0,4 M = 0,8 M = 8 x 10-1 M
pH = – log[H+] = – log 8 x 10-1 M = 1 – log 8
PEMBAHASAN :
NH4OH merupakan basa lemah sehingga terionisasi sebagian. Untuk menentukan derajat ionisasinya menggunakan rumusan:
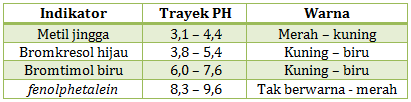
Diketahui trayek perubahan warna indikator sebagai berikut:
- terhadap indikator metil jingga memberi warna kuning
- terhadap indikator bromkresol hijau memberi warna biru
- terhadap indikator bromtimol biru memberi warna biru
- terhadap indikator fenolphtalein tidak memberi warna.
Perkiraan pH sampel air tersebut adalah….
PEMBAHASAN :
Dalam mengerjakan soal ini cukup melihat posisi warna yang diperlihatkan dengan pH nya. Jika warna yang diperlihatkan berada di kanan, maka pHnya di atas angka yang kanan. Jika warna yang diperlihatkan di kiri maka pHnya di bawah angka yang kiri. Jika warnanya perpaduan warna kiri kanan. maka PH nya berada di rentan angka kiri kanan.
- sampel air dengan metil jingga memberi warna kuning artinya pH di atas 4,4
- sampel air dengan bromkresol hijau memberi warna biru artinya pH di atas 5,4
- sampel air dengan bromtimol biru memberi warna biru artinya pH di atas 7,6
- sampel air dengan metil fenolphtalein tidak memberi warna artinya pH di bawah 8,3
Jika lebih darinya ada lebih dari satu ambil angka yang terbesar. Dari data tersebut lebih darinya ada 3 yaitu diatas 4.4, di atas 5.4, di atas 7.6. Sehingga diambil diatas 7.6 dan di bawah 8.3. jika dituliskan menjadi
7.6 < pH < 8.3
PEMBAHASAN :
K2O merupakan oksida basa. Jika direaksikan dengan air maka akan menghasilkan larutan basa KOH.
K2O + H2O → 2KOH
Dalam netralisasi berlaku
mol H+ = mol OH+
a.Ma.Va = b.Mb.Vb (a = valensi asam/jumlah H+, b = valensi basa/jumlah OH–)
2. 0,1 M. 30 ml = 1. Mb. 25 ml
![]()
n KOH = M x V = 0,24 x 1 L = 0,24 mol
n K2O = 1/2 x 0,24 mol = 0,12 (dihitung lewat perbandingan dengan koefisien)
Gr K2O = n x Mr = 0,12 x 94 = 11,28 gr
Maka kadarnya:
![]()
PEMBAHASAN :
Dalam reaksi penetralan berlaku:
mol H+ = mol OH–
Karena H+ berasal dari dua zat asam yaitu HBr dan H2SO4 maka perlu dicari mol H+ total
![]()
![]()
Dalam menentukan mol H+ dari H2SO4 dikali 2 karena valensi asamnya/jumlah H+ nya = 2
maka volume basanya
mol H+ = mol OH–
30 mmol = b.Mb.Vb
30 =1. 0,2 M. Vb
![]()
PEMBAHASAN :
Dalam netralisasi berlaku:
mol H+ = mol OH–
a.Ma.Va = b.Mb.Vb
1. 0,4 M. 100 = 2. n ( n = Mb. Vb)
n = 20 mmol = 2 x 10-2 mol
Menentukan Mr menggunakan rumusan
![]()
![]()
Menentukan Ar M
Mr M(OH)2 = Ar M x 1 + Ar O x 1 + Ar H x 2
158 = Ar M + 16 + 1 x 2
Ar M = 158 – 18 = 140
PEMBAHASAN :
Menentukan asam konjugasi berarti HCO3– nya sendiri bersifat basa. Pertanyaan ini berdasarkan teori asam basa Bronsted-Lowry. Basa menurut Bronsted-Lowry merupakan penerima proton (H+) sehingga untuk menentukan asam konjugasinya maka basa perlu ditambah 1H+. Sehingga Asam konjugasi dari HCO3– adalah H2CO3
PEMBAHASAN :
CaO merupakan oksida basa yang jika direaksikan dengan air akan menghasilkan basanya
CaO + H2O → Ca(OH)2
Menentukan mol masing-masing
![]()
n Ca(OH)2 akan sama dengan nCaO karena koefisiennya sama
nCa(OH)2 = 0,1 mol
Mereaksikan Ca(OH)2 dengan HCl
mol HCl = 0,1 M x 1 l = 0,1 mol
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
mula2 0,1 0,1 – –
reaksi 0,05 0,1 – 0,05 0,1 +
sisa 0,05 – 0,05 0,1
Karena yang bersisa adalah Ca(OH)2 maka pH campuran akan bersifat basa, karena termasuk basa kuat maka rumusannya
![]()
[OH–] = b.Mb = 2. 0,05 M = 0,1 M = 10-1 M
pOH = 1
pH = 14 – 1 = 13
PEMBAHASAN :
Karena NaOH merupakan basa maka pH kita ubah ke pOH
pOH = 14 – pH = 14 – 12 = 2
[OH-] = 10-2
Karena basa kuat maka rumusannya
[OH-] = b. Mb
![]()
![]()
Gr = 160 x 10-2 = 1,6 gram
PEMBAHASAN :
Menentukan Molaritas KOH setelah pengencaran menggunakan rumus pengenceran
M1. V1 = M2. V2
0,01 M . 0,2 L = M2 . 2 L
![]()
Maka pH setelah pengenceran adalah
[OH–] = b. Mb = 1 x 10-3 M = 10-3 M
pOH = 3
pH = 14 – pOH = 14 – 3 = 11
PEMBAHASAN :
Menentukan Ka dapat menggunakan rumus:
![]()
Ka = α2 . M
Ka = (1%)2 . 0,1 M = (0,01)2 . 0,1
Ka = 10-4 . 0,1 = 10-5
PEMBAHASAN :
Menentukan molaritas NaOH
![]()
Menentukan pH NaOH (basa kuat)
[OH-] = b. Mb = 1 x 10-2 M = 10-2 M
pOH = 2
pH = 14 – pOH = 14 – 2 = 2
PEMBAHASAN :
Diketahui:
![]()
n HCl = M x V = M x 150 ml = 150M mmol = 150 x 10-3 M mol = 0,15M mol
pH = 7 tercapai jika HCl (asam kuat) dan Ca(OH)2 (basa kuat) habis bereaksi

Maka nilai M adalah
0,015 – 0,075M = 0
0,015 = 0,075M
![]()
- konsentrasi H+ di dalam larutan basa yang diketahui [OH–] = 10-3 M
- konsentrasi OH– di dalam larutan asam yang memiliki pH = 4 – log 3
PEMBAHASAN :
- Menentukan [H+] di dalam larutan basa yang diketahui [OH–] = 10-3 M
Rumusan Kw yaitu:
Kw = [H+][OH–] 10-14 = [H+]. 10-3

- Menentukan [OH–] di dalam larutan asam yang memiliki pH = 4 – log 3
Karena pH = 4 – log 3, maka [H+] = 3.10-4 M
Rumusan Kw yaitu:
Kw = [H+][OH–] 10-14 = 4.10-3 . [OH–]
PEMBAHASAN :
Menentukan nilai [OH–]
[OH–] = α. Mb = 0,1. 0,2 = 0,02 M
Menentukan nilai Kb
![]()
Kb = α2 . Mb
Kb = (0,1)2 . 0,2 = 0,01 . 0,2 = 0,002 = 2 x 10-3
PEMBAHASAN :
Menentukan nilai α
![]()
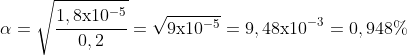
PEMBAHASAN :
Menentukan molaritas larutan
![]()
Menentukan pH
Karena Ca(OH)2 merupakan basa kuat maka terlebih dahulu menentukan [OH–]
[OH–] = b x Mb = 2 x 4 x 10-2 = 8 x 10-2
pOH = 2 − log 8
pH = 14 − ( 2 − log 8)
pH = 12 + log 8
PEMBAHASAN :
Menentukan mol masing-masing
n HBr = M x V = 0,02 M x 100 ml = 2 mmol
n Ba(OH)2 = M x V = 0,01 M x 200 ml = 2 mmol
Tuliskan persamaan reaksi dan disetarakan
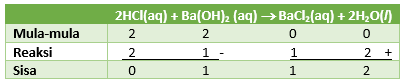
karena yang bersisa adalah Ba(OH)2 maka pH campuran akan bersifat basa
[OH–] = b x Mb = 2 x ![]() = 2 x
= 2 x ![]()
pOH = 3 − log 3,34
pH = 14 − ( 3 − log 3,34)
pH = 11 + log 3,34